European Case Law Identifier: ECLI:AT:OGH0002:2011:0170OB00014.10Y.0216.000
Spruch:
Dem außerordentlichen Revisionsrekurs wird teilweise Folge gegeben.
Der angefochtene Beschluss wird teils bestätigt und teils dahin abgeändert, dass er als Teilbeschluss lautet:
„Einstweilige Verfügung:
Zur Sicherung des mit Klage geltend gemachten Anspruchs auf Unterlassung unlauterer Handlungen wird der erst- und der zweitbeklagten Partei bis zur Beendigung des Rechtsstreits verboten, im geschäftlichen Verkehr das Produkt 'Relaxx Pastillen' in Österreich ohne arzneimittelrechtliche Zulassung als Arzneimittel iSv § 1 Abs 1 Z 1 AMG in Verkehr zu bringen, dies insbesondere dadurch, dass dem Produkt die Wirkung zugeschrieben wird, den Blutdruck und gefährliche Blutfette zu senken.
Hingegen wird das Mehrbegehren abgewiesen, allen drei beklagten Parteien zu untersagen, im geschäftlichen Verkehr
a. die Bezeichnung 'RELAXX', insbesondere in Form der in der Begründung dieser Entscheidung dargestellten Marke der drittbeklagten Partei, oder mit dieser verwechselbar ähnliche Zeichen in Österreich zu Zwecken der Bewerbung (beispielsweise in Form von Plakaten, Werbetafeln, Anzeigen, Einschaltungen in Tageszeitungen und Zeitschriften und im Internet unter der Domain www.relaxx.at ), der Herstellung, des Vertriebs (einschließlich des Inverkehrbringens, der Einfuhr und der Ausfuhr) von Arzneimitteln, Nahrungsergänzungsmitteln und mit diesen verwandten Produkten, insbesondere eines pflanzlichen Beruhigungsmittels in der in der Begründung dieser Entscheidung dargestellten Produktaufmachung, kennzeichenmäßig zu verwenden, sowie
b. das Produkt 'Relaxx Pastillen', insbesondere in der in der Begründung dieser Entscheidung dargestellten Aufmachung, in Österreich als Nahrungsergänzungsmittel oder als ein mit Arzneimitteln oder Nahrungsergänzungsmitteln verwandtes Produkt in Verkehr zu bringen, einzuführen, auszuführen oder zu vertreiben, oder es als Arzneimittel einzuführen, auszuführen oder zu vertreiben.“
In der Abweisung des Begehrens, auch der drittbeklagten Partei zu untersagen, das Produkt „Relaxx Pastillen“ in Österreich als Arzneimittel in Verkehr zu bringen, dies insbesondere dadurch, dass dem Produkt die Wirkung zugeschrieben werde, den Blutdruck und gefährliche Blutfette zu senken, werden die Beschlüsse der Vorinstanzen einschließlich der auf diesen Teil des Streitgegenstands entfallenden Kostenentscheidung aufgehoben, und die Rechtssache wird insofern zur neuerlichen Entscheidung nach Verfahrensergänzung an das Erstgericht zurückverwiesen.
Die klagende Partei hat im Verhältnis zur erst- und zur zweitbeklagten Partei ein Viertel ihrer Kosten des Sicherungsverfahrens aller drei Instanzen vorläufig selbst zu tragen, sie hat im Verhältnis zu allen beklagten Parteien drei Viertel dieser Kosten endgültig selbst zu tragen.
Die klagende Partei ist schuldig, den beklagten Parteien binnen 14 Tagen drei Viertel ihrer Kosten des Sicherungsverfahrens aller drei Instanzen zu ersetzen, das sind bei der erst- und der zweitbeklagten Partei jeweils 1.356,28 EUR (darin jeweils 226,05 EUR Umsatzsteuer) und bei der drittbeklagten Partei 1.734,83 EUR (darin 289,14 EUR Umsatzsteuer).
Die auf den von der Aufhebung betroffenen Teil des Streitgegenstands entfallenden Kosten des Revisionsrekursverfahrens sind weitere Verfahrenskosten.
Begründung:
Die Klägerin ist Inhaberin der für Waren der Klasse 5 (pharmazeutische und veterinärmedizinische Erzeugnisse sowie Präparate für die Gesundheitspflege; diätetische Erzeugnisse für medizinische Zwecke) registrierten österreichischen Wort-Bild-Marke Nr 197.702:
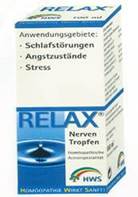
Sie vertreibt Arzneimittel (Nerventropfen seit 1999 und Nerventabletten seit 2004) in folgender Aufmachung:
Die Erstbeklagte vertreibt seit 2009 über Apotheken ein Erzeugnis mit folgender Aufmachung:
Auf einer Seitenlasche der Verpackung wird das Erzeugnis als „Nahrungsergänzungsmittel“ bezeichnet; durch Fettdruck und Großbuchstaben hervorgehoben ist dort aber der Hinweis „NUR IN APOTHEKEN“. Auf der Längsseite wird unter der Überschrift „Wirkungsweise“ eine „Gefäßerweiterung mit geringer Blutdrucksenkung“ und eine „Senkung gefährlicher Blutfette“ verheißen. Weiters soll das Produkt den Stoffwechsel und den Geist anregen, zugleich aber auch auf natürliche Weise Körper und Geist beruhigen. Das in Rotwein enthaltene Polyphenol wirke äußerst positiv auf das Gefäßsystem, die „Produktion freier Radikale“ durch Stress und andere Belastungen werde deutlich eingedämmt.
Der Zweitbeklagte ist Geschäftsführer der Erstbeklagten. Die Drittbeklagte ist eine Aktiengesellschaft aus Liechtenstein. Sie ist Inhaberin der am 30. Oktober 2008 ua für Waren der Klasse 5 (mineralische Nahrungsergänzungsmittel, energieaufbauende Nahrungsergänzungsmittel [Energieaufbaukonzentrate]) und 30 (Pastillen [Süßwaren, Bonbons]) angemeldeten österreichischen Wort-Bild-Marke Nr 249.061:
Bei einer für die Gesamtbevölkerung repräsentativen Umfrage gaben 2,4 % der Auskunftspersonen auf die Frage, welche Nerventropfen sie kennen, „Relax“/„Relaxx“ an. Bei einer gestützten Befragung gaben 7 % der Auskunftspersonen an, die Marke der Klägerin zu kennen, 3,9 % jene der Drittbeklagten. Feststellungen zur Bekanntheit der Produktaufmachungen haben die Vorinstanzen nicht getroffen.
Die Angaben über die Wirkung des Erzeugnisses der Beklagten sind wissenschaftlich belegt.
Zur Sicherung ihres mit Klage geltend gemachten Anspruchs beantragt die Klägerin, den Beklagten „im geschäftlichen Verkehr und auch zu Zwecken des Wettbewerbs“ zu untersagen,
a. die Bezeichnung „RELAXX“, insbesondere in Form der Marke der drittbeklagten Partei, oder mit dieser verwechselbar ähnliche Zeichen in Österreich zu Zwecken der Bewerbung (beispielsweise in Form von Plakaten, Werbetafeln, Anzeigen, Einschaltungen in Tageszeitungen und Zeitschriften und im Internet unter der Domain www.relaxx.at ), der Herstellung, des Vertriebs (einschließlich des Inverkehrbringens, der Einfuhr und der Ausfuhr) von Arzneimitteln, Nahrungsergänzungsmitteln und mit diesen verwandten Produkten, insbesondere eines pflanzlichen Beruhigungsmittels in der derzeit verwendeten Aufmachung, kennzeichenmäßig zu verwenden, sowie
b. das Produkt „Relaxx Pastillen“, insbesondere in der derzeit verwendeten Aufmachung, in Österreich als Arzneimittel, Nahrungsergänzungsmittel oder mit diesen verwandten Produkten in Verkehr zu bringen, einzuführen, auszuführen oder zu vertreiben.
Die Beklagten hätten sich mit ihrer Produktaufmachung bewusst an den bereits bekannten Erzeugnissen der Klägerin orientiert. Sie hätten damit in die ältere Marke der Klägerin eingegriffen, es bestehe Verwechslungsgefahr. Der Markenbestandteil „relax“ sei ein starkes Zeichen und habe überdies Verkehrsgeltung. Weiters verstießen die Beklagten gegen das Verbot irreführender Geschäftspraktiken. Sie erweckten den Eindruck, ihr Produkt stamme von der Klägerin (Z 13 des Anhangs zum UWG), darüber hinaus liege unzulässiges Imitationsmarketing vor (§ 2 Abs 3 Z 1 UWG). Die Beklagten führten das Publikum auch darüber in die Irre, dass es sich nur um ein Nahrungsergänzungsmittel und nicht um ein Arzneimittel handle (§ 2 Abs 1 Z 2 UWG); die Bezeichnung „Nahrungsergänzungsmittel“ sei kaum lesbar. Weiters liege eine sittenwidrige Rufausbeutung vor (§ 1 Abs 1 Z 1 UWG). Letztlich verstießen die Beklagten in vorwerfbarer Weise gegen das Arzneimittelgesetz (Vertrieb eines Präsentationsarzneimittels [Blutdruck- und Blutfettsenkung] ohne Zulassung), das Lebensmittelsicherheits- und Verbraucherschutzgesetz (krankheitsbezogene Angaben bei einem Lebensmittel) und ‑ mangels wissenschaftlicher Grundlagen der gesundheitsbezogenen Angaben - gegen Art 13 Abs 1 der VO (EG) Nr 1924/2006 (Health ClaimsVO). Die drei Beklagten hätten zusammengewirkt: Die Erstbeklagte vertreibe das Produkt, der Zweitbeklagte sei ihr Geschäftsführer. Die Drittbeklagte verfüge über die Marke „relaxx“ und habe der Erstbeklagten eine Lizenz eingeräumt. Zudem stehe sie beim Vertrieb der Pastillen „hinter“ den Handlungen der Erst- und des Zweitbeklagten. Jedenfalls hafte die Drittbeklagte aber als Gehilfin, weil sie die rechtswidrigen Handlungen der Erst- und des Zweitbeklagten durch das Zurverfügungstellen der Marke erst ermöglicht habe.
Die Beklagten bestreiten beide Teile des Begehrens. Gegenüber der Marke der Klägerin bestehe ein ausreichender Abstand; deren Wortbestandteil „relax“ sei beschreibend und daher nicht isoliert schutzfähig. Eine absichtlich herbeigeführte Herkunftstäuschung liege nicht vor. Das Erzeugnis der Beklagten sei anders aufgemacht als jenes der Klägerin (Schriftzug, Farbe, Design, Verpackungsgröße, stilisiertes Siegel, charakteristischer Hintergrund). Das Produkt der Klägerin werde demgegenüber als „nüchternes“ Medikament wahrgenommen; das bloße Anbringen eines identen Zeichens auf einem sonst unterschiedlichen Produkt begründe keine Ähnlichkeit. Mangels Bekanntheit des Zeichenbestandteils „RELAX“ sei eine Anlehnung an das Produkt oder die Marke der gefährdeten Partei ausgeschlossen, weshalb keine Rufausbeutung iSd § 1 UWG vorliege. Der Zweitbeklagte sei nur geschäftsführender Gesellschafter der Erstbeklagten, mit der Drittbeklagten gebe es kein Zusammenwirken.
Das Erstgericht wies den Sicherungsantrag ab. Das Wort „relax“ habe beschreibenden Charakter für beruhigende Substanzen und sei daher nicht schutzfähig; ein Unterscheidungskraft begründender Kennzeichnungsgrad sei nicht nachgewiesen. Zur Marke der Klägerin bestehe ein ausreichender Abstand. Ansprüche nach § 2 UWG würden wegen der Spezialität des MSchG verdrängt. Das Produkt der Beklagten werde unter Bedachtnahme auf den Gesamteindruck nicht als Arzneimittel beworben. Aus dem Umstand, dass „RELAXX“-Pastillen nur in Apotheken erhältlich seien, sei nicht auf die Arzneimitteleigenschaft zu schließen. Auch der Werbeaufwand der Klägerin werde von den Gegnern nicht in sittenwidriger Weise ausgenutzt, da der Begriff „relax“ nicht (ausreichend) der Klägerin zugeordnet würde. Das Wort „Nahrungsergänzungsmittel“ sei auf einer Seitenlasche angebracht, was ausreiche.
Das Rekursgericht bestätigte diese Entscheidung und sprach aus, dass der Wert des Entscheidungsgegenstands 30.000 EUR übersteige und der ordentliche Revisionsrekurs nicht zulässig sei.
Das Erstgericht habe zutreffend die (isolierte) Schutzfähigkeit des Markenbestandteils „relax“ verneint. Bei einem Vergleich der „Marken“ entscheide der Gesamteindruck. Die Wort-Bild-Marke der Klägerin sei „nüchtern“ aufgemacht, die Buchstaben einer gängigen Schrift entnommen. Weiters gebe es Zusätze (HWS; Baum- und Regenbogenbild). In der „Marke“ (gemeint wohl: in der Produktaufmachung) der Beklagten sei das Wort „RELAXX“ gelb gehalten und eigentümlich gestaltet. Auf den ersten Blick würden die Buchstaben nicht als Wort, sondern als graphische Form wahrgenommen. Die dominierende Farbe sei Blau. Schriftart, Farbe, Hintergrundgestaltung und die zusätzlichen Doppelbuchstaben „XX“ wichen deutlich von der Wort-Bild-Marke der Klägerin ab. Markenrechtliche Ansprüche bestünden daher nicht. Ein ergänzender wettbewerbsrechtlicher Schutz komme nur in Betracht, wenn es im Einzelfall zusätzliche Umstände gebe, die die Annäherung an die fremde Kennzeichnung als eine unlautere Werbemaßnahme im Sinne einer Rufausbeutung erscheinen ließen. Das treffe hier wegen der unterschiedlichen Produktaufmachung nicht zu. Der geringe Bekanntheitsgrad der Produkte der Klägerin jeweils unter 10 % schließe eine Rufausbeutung aus. Der von der Rekurswerberin aufgezeigte Rechtsbruch liege nicht vor. Beim Produkt der Beklagten handle es sich schon wegen der natürlichen Zutaten (Rotwein, frische Petersilie und Bienenhonig) um ein Nahrungsergänzungmittel nach dem LMSVG; eine Prüfung nach dem Arzneimittelgesetz scheide daher aus. Die an den Kopfseiten angebrachte Bezeichnung als „Nahrungsmittelergänzung“ erfülle die Voraussetzungen der Lebensmittelkennzeichnungsverordnung. Soweit die Klägerin unter Berufung auf die Health ClaimsVO die mangelnde wissenschaftliche Untermauerung der Behauptungen der Beklagten behaupte, entferne sie sich vom festgestellten Sachverhalt.
Rechtliche Beurteilung
Der gegen diese Entscheidung gerichtete Revisionsrekurs der Klägerin ist zulässig, weil das Rekursgericht die Rechtsprechung zum Arzneimittelbegriff nicht beachtet hat; er ist aus diesem Grund teilweise berechtigt.
1. Zu Punkt (a) des Begehrens (Imitationsmarketing, sittenwidrige Rufausbeutung)
1.1. Die Klägerin bekämpft im Revisionsrekurs ausdrücklich nicht die Auffassung des Rekursgerichts, dass der Wortbestandteil ihrer Marke („RELAX“) beschreibend sei und auch nicht durch Benutzung Unterscheidungskraft erlangt habe. Zu diesen vom Rekursgericht zutreffend gelösten Fragen ist daher nicht weiter Stellung zu nehmen. Auch auf den Ausstattungsschutz nach § 9 Abs 3 UWG stützt sich die Klägerin nicht.
1.2. Als Grundlage für Punkt (a) des Begehrens nennt die Klägerin im Revisionsrekurs zunächst § 2 Abs 3 Z 1 UWG. Danach gilt eine Geschäftspraktik als irreführend, wenn sie die wirtschaftliche Entscheidung eines Marktteilnehmers beeinflussen kann und „eine Verwechslungsgefahr mit einem Produkt oder Unternehmenskennzeichen eines Mitbewerbers“ begründet.
(a) Diese Bestimmung erfasst insbesondere Produktaufmachungen, die vom Verkehr als Unternehmenskennzeichen verstanden werden. Der Senat hat dazu in 17 Ob 7/09t (= ÖBl 2010, 20 [Gamerith] ‑ Das blaue Wunder) ausgesprochen, dass Verkehrsgeltung nicht Tatbestandsmerkmal dieser Regelung sei. Dem haben Gamerith (ÖBl 2010, 23) und Horak (ecolex 2009/342) in Entscheidungsanmerkungen zugestimmt; zuvor hatten sich schon W. Schuhmacher (RL 2005/29/EG des EP und des Rates über unlautere Geschäftspraktiken im binnenmarktinternen Geschäftsverkehr zwischen Unternehmen und Verbrauchern, wbl 2007, 557 [561 ff] und Anderl/Appl (in Wiebe/G. Kodek, UWG [2009] § 2 Rz 461) in diesem Sinn geäußert.
(b) Hingegen wird zur entsprechenden Bestimmung des deutschen Rechts (§ 5 Abs 2 dUWG) die Auffassung vertreten, dass Verwechslungsgefahr der Natur der Sache nach nur bestehen kann, wenn die Bezeichnung (Produktaufmachung) von einem relevanten Teil des Verkehrs als Herkunftshinweis gesehen wird (Pfeifer in Fezer, Lauterkeitsrecht2 [2010] II § 5 Rz 317); das deckt sich mit dem Erfordernis der Verkehrsgeltung (so ausdrücklich Bornkamm in Köhler/Bornkamm, UWG28 [2010] § 5 Rz 4.125; vgl auch ders, Die Schnittstelle zwischen gewerblichem Rechtsschutz und UWG, GRUR 2011, 1 [5 f]). Ähnlich argumentieren in Österreich Duursma/Duursma-Kepplinger (in Gumpoldsberger/Baumann, UWG-Kommentar, Ergänzungsband [2009] § 2 Rz 61), Wiltschek/Majchrzak (Die UWG-Novelle 2007: Die Umsetzung der Richtlinie über unlautere Geschäftspraktiken in Österreich, ÖBl 2008, 4 [11]) und früher auch Gamerith (Wettbewerbsrechtlicher Kennzeichenschutz durch die RL-UGP: Welche Änderungen bringt § 2 Abs 3 Z 1 UWG? ÖBl 2008, 174 [177 f]). Nach diesen Autoren kann eine Produktausstattung nur dann ein „Unternehmenskennzeichen“ sein, wenn sie im Verkehr bekannt ist.
(c) Hintergrund der letztgenannten Auffassung ist offenkundig § 9 Abs 3 UWG, wonach Produktausstattungen nur dann geschützt sind, wenn sie „innerhalb beteiligter Verkehrskreise als Kennzeichen des Unternehmens gelten“. Auch der EuGH nimmt das Vorliegen eines „Unterscheidungszeichens“ iSv Art 3a Abs 1 lit g der RL 84/450/EG (nunmehr 5 lit h der RL 2006/114/EG über irreführende und vergleichende Werbung) an, wenn „es vom Verkehr als von einem bestimmten Unternehmen stammend identifiziert wird“ (Rs C-112/99, Toshiba/Katun, Slg 2001, I‑7945). Es liegt daher unabhängig von § 9 Abs 3 UWG nahe, auch den Kennzeichenbegriff in § 2 Abs 3 Z 1 UWG (Art 6 Abs 2 lit a RL-UGP) in diesem Sinn zu verstehen.
Diese Auffassung stimmt mit dem Regelungszweck der letztgenannten Bestimmungen überein: Ob die dort maßgebende Verwechslungsgefahr vorliegt, ist aus der Sicht eines Durchschnittsverbrauchers zu beurteilen; es ist zu fragen, ob er im konkreten Fall aufgrund der Aufmachung annehmen könnte, dass ein Produkt aus einem bestimmten anderen Unternehmen stammt. Das setzt wohl voraus, dass der Durchschnittsverbraucher (maW ein nicht unerheblicher Teil der angesprochenen Kreise) die angeblich nachgeahmte Aufmachung kennt und als Hinweis auf ein bestimmtes (anderes) Unternehmen versteht.
Folgt man dieser Auffassung, wäre in der Sache auch für § 2 Abs 3 Z 1 UWG ‑ ebenso wie für § 9 Abs 3 UWG ‑ Verkehrsgeltung der Ausstattung erforderlich. Dies entspräche dem allgemeinen Grundsatz, dass lauterkeitsrechtliche Regelungen nicht dazu dienen dürfen, die Grenzen des kraft Verkehrsgeltung gewährten kennzeichenrechtlichen Schutzes ohne weiteres zu unterlaufen (RIS-Justiz RS0114532). Die eigenständige Bedeutung von § 2 Abs 3 Z 1 UWG läge bei dieser Auslegung im unterschiedlichen Schutzzweck und vor allem in der gegenüber § 9 UWG erweiterten Klagelegitimation (§ 14 UWG: auch Mitbewerber und Verbände).
(d) Im vorliegenden Fall sind diese Fragen aber nicht weiter zu prüfen. Denn schon die Vorinstanzen haben zutreffend erkannt, dass selbst im Fall der Verkehrsgeltung keine Verwechslungsgefahr vorläge. Die Ausstattungen sind sich zwar in den Bezeichnungen „Relax“ bzw „Relaxx“ ähnlich. Dieser Teil hat aber wegen des ‑ nun auch von der Klägerin zugestandenen ‑ beschreibenden Charakters keine wettbewerbliche Eigenart, weshalb ihm bei der Prüfung der (konkreten) Verwechslungsgefahr nur geringes Gewicht zukommt. Ansonsten halten die Beklagten deutlichen Abstand. Zwar weisen beide Packungen blaue Elemente auf. Während aber die Packung der Beklagten zur Gänze in dieser Farbe gehalten ist, überwiegen bei jener der Klägerin weiße Flächen. Der Farbton ist deutlich verschieden, sodass sich insgesamt ein unterschiedlicher Eindruck ergibt: Die Packungen der Klägerin wirken eher hell, jene der Beklagten dunkel. Der jeweils hervorstechende Schriftzug „Relax“ bzw „Relaxx“ ist unterschiedlich gestaltet, und die Verpackungen weisen zusätzliche Elemente auf (Dreiecksmuster und stilisiertes Siegel mit Frauenfigur bei den Beklagten; Wassertropfen und Regenbogen bei der Klägerin). Selbst wenn die Verpackungen der Klägerin bekannt wären, nähme der Durchschnittsverbraucher auf dieser Grundlage nicht an, dass auch das Produkt der Beklagten aus dem Unternehmen der Klägerin stamme. Dazu kommt, dass beide Erzeugnisse in Apotheken abgegeben werden, was wegen der damit verbundenen Beratung durch Fachpersonal die Gefahr einer Verwechslung weiter vermindert. Ein Anspruch nach § 2 Abs 3 Z 1 UWG besteht daher nicht.
1.3. Die Klägerin stützt Punkt (a) ihres Begehrens auch auf unlautere Rufausbeutung (§ 1 Abs 1 Z 1 UWG).
(a) Wettbewerbsrechtlicher Schutz gegen Rufausbeutung wird nur gewährt, wenn sich der Verletzer an Ruf und Ansehen einer fremden Ware (Leistung) anhängt und diese für den Absatz seiner Ware auszunutzen versucht (4 Ob 305/98a = ÖBl 1999, 191 ‑ Red Puma). Dabei ist das Anlehnen an eine fremde Leistung und das Ausnutzen eines guten Rufs nicht stets verwerflich. Es muss zur objektiven Rufausbeutung etwas Anstößiges hinzutreten, Anhaltspunkte dafür bilden etwa die Verwendung identischer Zeichen und die - meist naheliegende, wenn nicht konkret widerlegte - Zielrichtung, am fremden Ruf zu schmarotzen (4 Ob 36/04d = ÖBl 2004, 217 [Gamerith] ‑ Firn; RIS-Justiz RS0118990). Jedenfalls erforderlich ist aber eine gewisse Ähnlichkeit, die zu Assoziationen mit dem Produkt des Mitbewerbers führt (4 Ob 305/98a = ÖBl 1999, 191 ‑ Red Puma).
(b) Schon diese ausreichende Ähnlichkeit fehlt hier aus den bereits dargestellten Erwägungen (oben 1.2.). Die Produktausstattungen der beiden Parteien sind ‑ abgesehen von der nicht kennzeichnungskräftigen Bezeichnung „Relax“ bzw „Relaxx“ - so verschieden, dass eine Rufübertragung bei realistischer Betrachtung ausscheidet. Punkt (a) des Begehrens kann daher auch nicht auf § 1 Abs 1 Z 1 UWG gestützt werden. Anders wäre zwar allenfalls zu entscheiden, wenn die Produktaufmachung der Klägerin in den angesprochenen Kreisen in besonders hohem Maße bekannt wäre, da in diesem Fall auch ein geringerer Ähnlichkeitsgrad eine Assoziation zu den Produkten der Klägerin auslösen könnte. Ein solcher Sachverhalt ist hier aber nicht bescheinigt.
1.4. Aufgrund dieser Erwägungen ist die Abweisung von Punkt (a) des Begehrens zu bestätigen.
2. Zu Punkt (b) des Begehrens vertritt die Klägerin die Auffassung, das Produkt der Beklagten sei aufgrund seiner Aufmachung als Arzneimittel einzustufen. In diesem Fall dürfte es nicht ohne eine ‑ hier unstrittig nicht vorliegende ‑ arzneimittelrechtliche Zulassung abgegeben werden. Die Klägerin stützt sich damit auf die lauterkeitsrechtliche Fallgruppe „Wettbewerbsvorsprung durch Rechtsbruch“.
2.1. Ein Verstoß gegen eine nicht dem Lauterkeitsrecht im engeren Sinne zuzuordnende generelle Norm ist als unlautere Geschäftspraktik oder als sonstige unlautere Handlung iSv § 1 Abs 1 Z 1 UWG zu werten, wenn die Norm nicht auch mit guten Gründen in einer Weise ausgelegt werden kann, dass sie dem beanstandeten Verhalten nicht entgegensteht (4 Ob 225/07d = MR 2008, 114 [Heidinger 108] = wbl 2008, 290 [Artmann 253] = ÖBl 2008, 237 [Mildner] = ecolex 2008, 551 [Tonninger] - Wiener Stadtrundfahrten; RIS-Justiz RS0123239). Maßgebend für die Beurteilung der Vertretbarkeit einer Rechtsauffassung sind der eindeutige Wortlaut und Zweck der angeblich übertretenen Norm sowie gegebenenfalls die Rechtsprechung der Gerichtshöfe des öffentlichen Rechts und eine beständige Praxis von Verwaltungsbehörden (4 Ob 225/07b - Wiener Stadtrundfahrten; zuletzt etwa mwN 4 Ob 40/09z = ÖBl‑LS 2009/239 [Mildner] ‑ Lademulden, und 4 Ob 14/09b). Hat der Oberste Gerichtshof schon selbst über die vertretbare oder unvertretbare Auslegung einer Norm des Verwaltungsrechts entschieden, ist selbstverständlich auch dessen Rechtsprechung zu beachten.
2.2. Arzneimittel dürfen nach § 7 Abs 1 AMG ‑ von hier nicht interessierenden Ausnahmen abgesehen ‑ nicht ohne Zulassung abgegeben (in den Verkehr gebracht) werden. Es ist daher zu prüfen, ob das Produkt der Beklagten ein Arzneimittel im Sinn dieses Gesetzes ist. Ausgangspunkt dafür ist § 1 Abs 1 Z 1 AMG:
(1) „Arzneimittel“ sind Stoffe oder Zubereitungen aus Stoffen, die nach der allgemeinen Verkehrsauffassung dazu dienen oder nach Art und Form des Inverkehrbringens dazu bestimmt sind, bei Anwendung am oder im menschlichen oder tierischen Körper
1. Krankheiten, Leiden, Körperschäden oder krankhafte Beschwerden zu heilen, zu lindern, zu verhüten oder zu erkennen.
Diese Bestimmung entspricht im Kern der unionsrechtlichen Definition des Begriffs „Arzneimittel“ in Art 1 Nr 2 der RL 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel (GemeinschaftskodexRL):
a. alle Stoffe oder Stoffzusammensetzungen, die als Mittel mit Eigenschaften zur Heilung oder zur Verhütung menschlicher Krankheiten bestimmt sind;
b. alle Stoffe oder Stoffzusammensetzungen, die im oder am menschlichen Körper verwendet oder einem Menschen verabreicht werden können, um entweder die menschlichen physiologischen Funktionen durch eine pharmakologische, immunologische oder metabolische Wirkung wiederherzustellen, zu korrigieren oder zu beeinflussen oder eine medizinische Diagnose zu erstellen.
a. Any substance or combination of substances presented as having properties for treating or preventing disease in human beings.
b. Any substance or combination of substances which may be used in or administered to human beings either with a view to restoring, correcting or modifying physiological functions by exerting a pharmacological, immunological or metabolic action, or to making a medical diagnosis.
a. Toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines,
b. toute substance ou composition pouvant être utilisée chez l'homme ou pouvant lui être administrée en vue soit de restaurer, de corriger ou de modifier des fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique, soit d'établir un diagnostic médical.
Die Arzneimitteleigenschaft kann sich damit sowohl aus der tatsächlichen Funktion (Art 1 Nr 2 lit b GemeinschaftskodexRL; „dazu dienen“ in § 1 Abs 1 AMG) als auch aus der Präsentation (Art 1 Nr 2 lit a GemeinschaftskodexRL; „dazu bestimmt“ in § 1 Abs 1 AMG) eines Stoffs als Arzneimittel ergeben (RIS-Justiz RS0051450 [insb T3, T7]; zuletzt etwa 4 Ob 27/08m = ÖBl 2008, 325 [Schultes] ‑ Zigarettenattrappe; EuGH Rs C-60/89, Monteil, Slg 1991 I-1547, Rz 10 f; zuletzt mwN EuGH Rs C-84/06, Antroposana, Slg 2007 I-07609, Rz 31). Auch pharmakologisch wirkungslose Erzeugnisse können aus diesem Grund bei einer entsprechenden Produktaufmachung unter den Arzneimittelbegriff fallen (4 Ob 27/08m ‑ Zigarettenattrappe mwN).
Die in § 1 Abs 1 AMG und in der deutschen Fassung von Art 1 Nr 2 lit a GemeinschaftskodexRL enthaltene Formulierung „dazu bestimmt“ ist ‑ wie sich insbesondere aus der englischen und französischen Fassung der Richtlinie ergibt ‑ ebenfalls im Sinn einer „Präsentation“ zu verstehen. Ursprünglich war auch deren deutsche Fassung entsprechend formuliert gewesen („alle Stoffe oder Stoffzusammensetzungen, die … bezeichnet werden“); erst mit der RL 2004/27/EG wurde das im Sinn der nunmehr geltenden Regelung geändert („zu Heilung oder Linderung … bestimmt“). Die englische und die französische Fassung blieben aber in diesem Punkt unverändert, und auch die Erwägungsgründe der Richtlinie bieten keine Erklärung für die Umformulierung. Damit steht außer Frage, dass der europäische Gesetzgeber hier keine grundlegende Änderung der unionsrechtlichen Arzneimitteldefinition - im Sinn einer Abkehr vom „Präsentationsarzneimittel“ - vornehmen wollte. Die oben dargestellte Rechtsprechung ist daher weiterhin maßgebend.
2.3. Bei der Prüfung, ob ein Präsentationsarzneimittel vorliegt, ist entscheidend, wie die angesprochenen Verkehrskreise die Angaben zum Produkt auffassen, nicht dagegen, wie sie der Werbende verstanden wissen wollte (4 Ob 74/92 = ÖBl 1993, 68 - CAPPILARIS Haaraktivator; RIS-Justiz RS0051461; zuletzt etwa 4 Ob 27/08m - Zigarettenattrappe).
2.4. Wendet man diese Grundsätze auf den vorliegenden Fall an, so erweist sich die Beurteilung der Vorinstanzen als verfehlt. Das Erzeugnis der Beklagten verspricht auf der Packung eine „Senkung der schädlichen Blutfette“ und eine ‑ wenngleich nur „geringe“ ‑ „Blutdrucksenkung“. Beide Aussagen beziehen sich auf die Linderung von krankhaften Beschwerden. Dazu kommt der gegenüber der Bezeichnung als „Nahrungsergänzungsmittel“ hervorgehobene Hinweis „NUR IN APOTHEKEN“, der im Verständnis der angesprochenen Kreise Arzneimitteleigenschaft suggeriert. Damit ist die Grenze zum Präsentationsarzneimittel eindeutig überschritten. Dass die Rechtsansicht der Beklagten unvertretbar ist, ergibt sich insbesondere aus der Entscheidung 4 Ob 301/86, die ebenfalls die Formulierung „zur Senkung des Blutdrucks“ betraf und daraus auf der Grundlage des schon damals geltenden § 1 Abs 1 Z 1 AMG die Arzneimitteleigenschaft des damit bezeichneten Tees ableitete.
Das Argument der Beklagten, der Hinweis auf eine „Rezeptur nach Hildegard von Bingen“ begründe die Ausnahme nach § 1 Abs 3 Z 9 AMG, greift auf dieser Grundlage nicht durch. Denn die letztgenannte Bestimmung nimmt zwar Stoffe vom Arzneimittelbegriff aus, die ausschließlich dazu bestimmt sind, nach „komplementärmedizinischen“ Methoden angewendet zu werden. Das gilt aber nach dem ausdrücklichen Wortlaut gerade nicht für Stoffe, die ‑ wie hier ‑ unter die Definition des § 1 Abs 1 Z 1 ‑ 4 AMG fallen (außer es handelte sich ‑ anders als hier ‑ um Homöopathika).
2.5. Als Zwischenergebnis ist daher festzuhalten, dass das Produkt der Beklagten aufgrund seiner Aufmachung die Arzneimitteldefinition des § 1 Abs 1 Z 1 AMG erfüllt. Da es über keine arzneimittelrechtliche Zulassung verfügt, ist seine Abgabe (das Inverkehrbringen) nach § 7 Abs 1 AMG unzulässig. Eine vertretbare Rechtsauffassung liegt nicht vor. Das hat folgende Auswirkungen auf die angefochtene Entscheidung:
(a) Der Unterlassungsanspruch ist gegen die Erstbeklagte und den Zweitbeklagten begründet, soweit er sich auf das Inverkehrbringen „als Arzneimittel“ bezieht; dies ist durch einen Hinweis auf die diese Eigenschaft begründenden Angaben auf der Verpackung zu konkretisieren. Das Verbot ist, wie schon im Antrag formuliert, auf Handeln im geschäftlichen Verkehr zu beschränken; der nichtssagende Zusatz „auch zu Zwecken des Wettbewerbs“ kann entfallen.
(b) Die Drittbeklagte soll nach dem Vorbringen der Klägerin „hinter“ dem Verhalten der Erst- und des Zweitbeklagten stehen. Damit behauptet die Klägerin, dass die Drittbeklagte für die Produktaufmachung verantwortlich sei und dass daher in Wahrheit auch sie tatbestandsmäßig (dh als unmittelbare Täterin) gehandelt habe (vgl 17 Ob 34/08m = ÖBl 2009, 254 ‑ Tonerkartuschen mwN). Dann wäre auch sie zur Unterlassung verpflichtet. Ob das zutrifft, lässt sich derzeit aber nicht beurteilen. Denn die Vorinstanzen haben aufgrund ihrer Auffassung, dass schon dem Grunde nach keine Ansprüche bestünden, keine Feststellungen zu einem tatbestandsmäßigen und damit Wiederholungsgefahr begründenden Verhalten der Drittbeklagten getroffen. Soweit die Vorinstanzen Ansprüche nach § 1 UWG iVm § 7 AMG gegen die Drittbeklagte verneint haben, sind ihre Entscheidungen daher aufzuheben, und die Rechtssache ist insofern an das Erstgericht zurückzuverweisen.
Zur Klarstellung ist festzuhalten, dass die Klägerin in ihrem Begehren nur ein Verhalten als unmittelbarer Täter untersagt wissen will. Ihr weiteres Vorbringen zur (bloßen) Gehilfeneigenschaft der Drittbeklagten ist davon nicht gedeckt. Denn in diesem Fall müsste sich das Begehren gegen den konkreten Tatbeitrag richten, nicht gegen das tatbestandsmäßige Verhalten der vom Gehilfen geförderten Person (Gamerith, Wettbewerbsrechtliche Unterlassungsansprüche gegen „Gehilfen“, wbl 1991, 305 [306]).
(c) § 7 AMG regelt nur die Abgabe (dh das Inverkehrbringen) von Arzneimitteln. Die Klägerin nennt keine gesetzliche Grundlage für ihr weiteres Begehren, den Beklagten auch die Ein- und Ausfuhr sowie das „Vertreiben“ als Arzneimittel zu untersagen. Von Amts wegen ist diese Grundlage im Lauterkeitsprozess nicht zu ermitteln; vielmehr ist es hier Aufgabe des Klägers, jene Regelungen aufzuzeigen, deren auf einer unvertretbaren Rechtsansicht beruhende Verletzung einen Wettbewerbsverstoß begründet (vgl zur insofern bestehenden Behauptungspflicht 4 Ob 62/06f = MR 2007, 156 ‑ Limited, Punkt 2.2). Wie sich das gesondert bekämpfte „Vertreiben“ vom ohnehin untersagten „Inverkehrbringen“ unterscheiden soll, legt die Klägerin nicht dar. Insofern ist der Antrag daher im Verhältnis zu allen Beklagten abzuweisen.
3. Zu Punkt (b) des Begehrens behauptet die Klägerin weiters einen Verstoß gegen lebensmittelrechtliche Vorschriften (Health ClaimsVO, LMSVG und LMKV).
3.1. Da es sich beim Produkt der Beklagten um ein Arzneimittel handelt, ist die VO (EG) Nr 1924/2006 über nährwert- und gesundheitsbezogene Angaben über Lebensmittel (Health ClaimsVO) nicht anwendbar. Denn diese Verordnung erfasst nach ihrem Art 1 Abs 2 nur nährwert- und gesundheitsbezogene Angaben, die „in kommerziellen Mitteilungen bei der Kennzeichnung und Aufmachung von oder bei der Werbung für Lebensmittel“ gemacht werden. Für den Begriff „Lebensmittel“ verweist Art 2 Abs 1 lit a Health ClaimsVO auf die Definition in Art 2 der VO (EG) Nr 178/2002 zur Festlegung der allgemeinen Grundsätze und Anforderungen des Lebensmittelrechts, zur Errichtung der Europäischen Behörde für Lebensmittelsicherheit und zur Festlegung von Verfahren zur Lebensmittelsicherheit (BasisVO). Art 2 Abs 3 lit d dieser VO ordnet aber an, dass Arzneimittel iSd europäischen Arzneimittelrechts keine Lebensmittel sind. Wird daher ein Stoff ‑ wie hier ‑ als Arzneimittel iSv § 1 Abs 1 Z 1 AMG (Art 1 Nr 2 GemeinschaftskodexRL) auf den Markt gebracht, unterliegt er ausschließlich den (strengeren) Bestimmungen des Arzneimittelrechts; eine gesonderte Prüfung einzelner Packungsangaben nach der Health ClaimsVO hat zu unterbleiben.
3.2. Auch § 3 Z 1 LMSVG verweist für den Begriff „Lebensmittel“ auf die Definition der BasisVO. Damit ist auch dieses Gesetz nicht anwendbar, weil ein Arzneimittel iSd ‑ in § 1 Abs 1 Z 1 AMG umgesetzten - europäischen Arzneimittelrechts vorliegt. Gleiches gilt für die Lebensmittel-Kennzeichnungsverordnung (LMKV).
3.3. Aufgrund dieser Erwägungen ist jener Teil des Begehrens abzuweisen, der sich auf das Inverkehrbringen und die Ein- und Ausfuhr „als Nahrungsergänzungsmittel“ (dh als Lebensmittel) bezieht. Grund dafür ist fehlende Erstbegehungsgefahr und fehlende Wiederholungsgefahr: Die Beklagten haben bisher ein Arzneimittel auf den Markt gebracht; ein Verstoß, der ein auf Lebensmittel bezogenes Verbot rechtfertigte, lag daher nicht vor und es bestehen auch keine Anhaltspunkte, dass er unmittelbar drohend bevorstünde. Was die Klägerin unter einem „Arzneimitteln oder Nahrungsergänzungmitteln verwandten Produkt“ versteht, ist nicht erkennbar; auch insofern ist das Begehren daher abzuweisen.
3.4. Anders wäre möglicherweise zu entscheiden, wenn das Produkt der Beklagten nur ein Arzneimittel iSv § 1 Abs 1 Z 5 AMG wäre, also nicht auch die Definition des § 1 Abs 1 Z 1 AMG erfüllte.
(a) Nach der erstgenannten Bestimmung sind Arzneimittel (auch) solche Stoffe, die dazu dienen oder dazu bestimmt sind, „die Beschaffenheit, den Zustand oder die Funktionen des Körpers oder seelische Zustände zu beeinflussen“. Dies erfasst zweifellos weitere Angaben auf der Verpackung der Beklagten (zB Anregung des Geistes und des Stoffwechsels; Eindämmung der Produktion von „freien Radikalen“; Beruhigung von Körper und Geist).
(b) Allerdings sind nach § 1 Abs 3 Z 1 AMG Lebensmittel im Sinn der BasisVO keine Arzneimittel im Sinn des AMG, wenn sie nicht unter § 1 Abs 1 Z 1 ‑ 4 AMG fallen. Bei Stoffen, die nur die Definition des § 1 Abs 1 Z 5 AMG erfüllen, geht daher (zumindest nach österreichischem Recht) die Eigenschaft als Lebensmittel gegenüber jener als Arzneimittel vor. Scheinbar gegenläufig ordnet zwar, wie bereits dargestellt, Art 2 Abs 3 lit d BasisVO an, dass Arzneimittel im Sinn des europäischen Arzneimittelrechts keine Lebensmittel im Sinn der BasisVO sind. Dies führte jedoch in der hier erörterten Fallgestaltung nur dann zur Anwendbarkeit des Arzneimittelrechts, wenn Stoffe iSd § 1 Abs 1 Z 5 AMG auch unter den europäischen Arzneimittelbegriff fielen (vgl dazu Zeinhofer, Der Begriff des Arzneimittels und seine Abgrenzung von anderen Produktkategorien [2007] 212 f).
(c) Dass das nicht zutrifft, ist wegen des engeren Wortlauts von Art 1 Nr 2 GemeinschaftskodexRL zumindest vertretbar. Dafür sprechen auch systematische Erwägungen: Die auf Lebensmittel beschränkte Health ClaimsVO regelt Angaben, die zweifellos auch die Bedingungen des § 1 Abs 1 Z 5 AMG erfüllten (zB Art 13 Abs 1 lit a Health ClaimsVO: Angaben zur „Bedeutung eines Nährstoffs oder einer anderen Substanz für Wachstum, Entwicklung und Körperfunktionen“). Wäre hier tatsächlich das (strengere) europäische Arzneimittelrecht anwendbar (Art 2 Abs 1 lit a Health ClaimsVO iVm Art 2 Abs 3 lit d BasisVO und Art 1 Nr 2 GemeinschaftskodexRL), verlöre die Health ClaimsVO in weiten Bereichen ihre praktische Wirksamkeit. Dieses Ergebnis ist dem europäischen Gesetzgeber zumindest im Zweifel nicht zu unterstellen (vgl RIS-Justiz RS0010053).
(d) Läge daher kein Arzneimittel iSv § 1 Abs 1 Z 1 AMG vor, so wären die allenfalls (auch) eine Arzneimitteleigenschaft nach § 1 Abs 1 Z 5 AMG begründenden Packungsangaben nicht nach den (strengeren) Regelungen des Arzneimittelrechts, sondern nach der Health ClaimsVO zu prüfen. In diesem Zusammenhang wäre aber zu beachten, dass die Europäische Kommission noch keine Liste nach Art 13 Abs 3 Health ClaimsVO verabschiedet hat. Damit kann aus der Übergangsvorschrift des Art 28 Abs 5 Health ClaimsVO in vertretbarer Weise abgeleitet werden, dass Angaben iSv Art 13 Abs 1 Health ClaimsVO zulässig sind, wenn sie „dieser Verordnung sowie den einschlägigen einzelstaatlichen Vorschriften“ entsprechen (vgl Meisterernst/Haber, Die VO (EG) 1924/2006 über nährwert- und gesundheitsbezogene Angaben, wrp 2007, 363 [387 f]; Meyer, Health Claims in Europa und den USA [2007] 186 f). Die Angaben müssten sich daher nach Art 13 Abs 1 Health ClaimsVO auf „allgemein anerkannte wissenschaftliche Nachweise stützen“. Dass ein solcher Nachweis, wie die Klägerin zu meinen scheint, nur durch ein Gutachten der Europäischen Behörde für Lebensmittelsicherheit erbracht werden könnte, lässt sich dieser Regelung nicht entnehmen. Es muss daher genügen, dass die behaupteten Wirkungen ganz allgemein durch wissenschaftliche Untersuchungen belegt sind. Ob daneben auch noch nationale lebensmittelrechtliche Vorschriften anwendbar sein könnten, ist hier nicht zu entscheiden.
4. Im Ergebnis ist daher die Abweisung von Punkt (a) des Sicherungsantrags zu bestätigen. Zu Punkt (b) des Sicherungsantrags ist eine auf das Inverkehrbringen als Arzneimittel beschränkte einstweilige Verfügung gegen die Erstbeklagte und den Zweitbeklagten zu erlassen; im Verhältnis zur Drittbeklagten sind die Entscheidungen der Vorinstanzen in diesem Umfang aufzuheben, und die Sache ist insofern an das Erstgericht zurückzuverweisen. Im Übrigen ist auch die Abweisung von Punkt (b) des Begehrens zu bestätigen.
5. Die Kostenentscheidung gründet sich auf § 393 Abs 1 EO iVm §§ 43 Abs 1, 50, 52 Abs 1 und 2 ZPO. Die Klägerin ist gegenüber allen Beklagten mit etwa drei Vierteln ihres Begehrens unterlegen. Sie hat daher drei Viertel ihrer Kosten endgültig selbst zu tragen und den Beklagten drei Viertel von deren Kosten zu ersetzen. Beim sowohl zum Hauptverfahren als auch zum Sicherungsverfahren eingebrachten Schriftsatz ON 9 gebührte in entsprechender Anwendung von Anm 4 zu TP 3 RATG nur eine Verbindungsgebühr von 25 %; diese haben die Beklagten aber nicht verzeichnet. Kopierkosten sind in der Regel nicht zu ersetzen (RIS-Justiz RS0122433).
Im Verhältnis zur Erst- und zum Zweitbeklagten hat sich die Klägerin mit etwa einem Viertel des Begehrens durchgesetzt; sie hat daher ein Viertel ihrer Kosten vorläufig selbst zu tragen.
Im Verhältnis zur Drittbeklagten ist der Streit wegen der Teilaufhebung zu etwa einem Viertel noch nicht erledigt; die darauf entfallenden Kosten des Revisionsrekursverfahrens sind weitere Verfahrenskosten.
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)