European Case Law Identifier: ECLI:AT:OGH0002:2018:E117427
Spruch:
Dem Revisionsrekurs wird Folge gegeben und der angefochtene Beschluss dahin abgeändert, dass der Beschluss des Erstgerichts wiederhergestellt wird.
Die klagende Partei ist schuldig, der beklagten Partei die mit 4.277,94 EUR bestimmten Kosten des Rechtsmittelverfahrens (darin 599,49 EUR USt und 681 EUR Barauslagen) binnen 14 Tagen zu ersetzen.
Begründung:
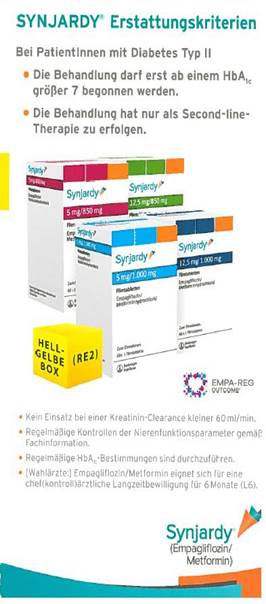
Die Parteien stehen in einem Wettbewerbsverhältnis auf dem Markt für Diabetesmedikamente. Die beklagte Partei bewarb ihre Produkte in einem 6-seitigen Folder gegenüber Ärzten mit folgenden herausgestellten Behauptungen:
Die Fachinformationen zu den beworbenen Medikamenten enthalten zahlreiche Ausführungen über die Wirksamkeit der beiden Arzneimittel und listen eine Reihe von Gegenanzeigen, Wechselwirkungen und Nebenwirkungen auf. Das Bundesamt für Sicherheit im Gesundheitswesen hat zudem zwei Warnhinweise veröffentlicht, wonach bei Patienten, die mit den Medikamenten der beklagten Partei behandelt wurden, schwerwiegende und manchmal lebensbedrohliche Fälle von diabetischer Ketoazitose aufgetreten seien. Weiters existiert eine in Fachkreisen vielbeachtete und aufsehenerregende klinische Studie, die zu positiven Ergebnissen kam. Demnach bewirkt der in den Medikamenten der beklagten Partei enthaltene Wirkstoff „Empagliflozin“ eine signifikante Reduktion von Herz- und Nierenerkrankungen bei Diabetes Typ II Patienten. Auf diese Studie wird in dem Folder mit dem Logo und der Kurzbezeichnung „EMPA-REG OUTCOME®“ wie folgt hingewiesen, was die angesprochenen Fachkreise auf die ihnen bekannte Studie beziehen:
Die klagende Partei beantragte, der beklagten Partei zur Sicherung ihres gleichlautenden Unterlassungsbegehrens mittels einstweiliger Verfügung zu verbieten, ihre Medikamente mit den Behauptungen „wirksam und verträglich“ oder „auf Herz und Nieren geprüft“ zu bewerben, ohne dies ausreichend zu belegen. Die Aussage „wirksam und verträglich“ sei im Sinne eines absoluten Wirksamkeitsversprechens und völliger Freiheit von Nebenwirkungen zu verstehen, was gegen § 50a Abs 3 Z 2 AMG verstoße. Ferner verstoße die Aussage gegen das Objektivitätsgebot nach § 50a Abs 3 Z 1 AMG und sei nicht ausreichend belegt. Dasselbe gelte für die Aussage „auf Herz und Nieren geprüft“. Damit werde suggeriert, dass strengere als die gesetzlich vorgesehenen Zulassungskriterien eingehalten worden seien. Entgegen § 55 Abs 2 und 4 AMG seien keine Belegstellen angeführt. Die Anzeige sei zudem irreführend nach § 6 Abs 2 AMG.
Die beklagte Partei verwies auf die umfangreichen Ausführungen in den Fachinformationen. Diese belegten auch die Wirksamkeit und Verträglichkeit. Ein weiterer Beleg sei nicht erforderlich. Es sei nicht ungewöhnlich und den angesprochenen Fachkreisen auch bekannt, dass mit der Einnahme eines Arzneimittels Neben- oder Wechselwirkungen verbunden sein könnten. Bei den beworbenen Arzneimitteln lägen keine Neben- oder Wechselwirkungen vor, die über das erwartbare Maß derartiger Arzneimittel hinausgingen. Die in den Medikamenten enthaltenen Wirkstoffe seien Gegenstand der Studie „EMPA-REG OUTCOME“ gewesen, die positive Ergebnisse bei einem kardiovaskulären Risiko bzw im Zusammenhang mit Nierenerkrankungen nachweise. Diese Studie sei im Folder ausreichend referenziert.
Das Erstgericht wies den Sicherungsantrag ab. Ausgehend vom eingangs zusammengefassten Sachverhalt verneinte es eine Irreführung ebenso wie einen Verstoß gegen die genannten Bestimmungen des AMG.
Das Rekursgericht erließ die einstweilige Verfügung antragsgemäß. Die gerügten Aussagen seien als Werbung mit Selbstverständlichkeiten zu qualifizieren. Es beurteilte die Werbeaussage „wirksam und verträglich“ als irreführend im Sinn des § 6 Abs 3 Z 1 AMG. Die angesprochenen Fachkreise verstünden die Aussage dahin, dass die Produkte gegenüber Konkurrenzprodukten wirksamer und verträglicher seien. Dies stehe in Widerspruch zu den Fachinformationen (§ 50a Abs 3 Z 3 AMG), weshalb auch ein Verstoß gegen das Objektivitätsgebot des § 50a Abs 3 AMG vorliege. Die Aussage „auf Herz und Nieren geprüft“ sei mangels eines Nachweises irreführend im Sinn des § 6 Abs 3 Z 2 AMG und verstoße als marktschreierische Werbung gegen § 50a Abs 3 AMG und § 55 Abs 2 AMG.
Das Rekursgericht sprach aus, dass der Wert des Entscheidungsgegenstands 30.000 EUR übersteige und der ordentliche Revisionsrekurs nicht zulässig sei.
Rechtliche Beurteilung
Der außerordentliche Revisionsrekurs der beklagten Partei, mit dem sie die Abänderung der einstweiligen Verfügung dahin anstrebt, dass der Sicherungsantrag abgewiesen werde, ist zur Klarstellung der Rechtslage zulässig und auch berechtigt.
1. „Wirksam und verträglich“
1.1. Das Rekursgericht hat die Wendung „wirksam und verträglich“ als eine irreführende Werbung mit Selbstverständlichkeiten qualifiziert.
1.1.1. Das arzneimittelrechtliche Irreführungs-verbot des § 6 AMG ist lex specialis zum allgemeinen lauterkeitsrechtlichen Verbot der Irreführung gemäß § 2 UWG (Retter/Stummer/Kresbach/Jergolla in Dieners/Reese, Handbuch des Pharmarechts, § 22 Rz 417). Die Bestimmung lautet:
§ 6. (1) Es ist verboten, Arzneimittel oder Wirkstoffe in Verkehr zu bringen, die den Tatsachen nicht entsprechende Angaben oder sonst zur Irreführung geeignete Bezeichnungen oder Aufmachungen aufweisen.
(2) Es ist ferner verboten, im Zusammenhang mit dem Inverkehrbringen von Arzneimitteln oder Wirkstoffen über diese den Tatsachen nicht entsprechende oder zur Irreführung geeignete Angaben zu machen.
(3) Eine Irreführung liegt insbesondere dann vor, wenn
1. den Arzneimitteln eine Wirksamkeit oder den Wirkstoffen eine Eigenschaft beigemessen wird, die nach dem jeweiligen Stand der wissenschaftlichen Erkenntnisse oder nach den praktischen Erfahrungen nicht hinreichend belegt ist, oder
2. fälschlich der Eindruck erweckt wird, daß ein Erfolg mit Sicherheit zu erwarten ist oder daß nach bestimmungsgemäßem oder längerem Gebrauch keine schädlichen Wirkungen eintreten, oder
[…].
1.1.2. § 6 Abs 3 AMG zählt nur beispielsweise („insbesondere“) Fälle auf, in denen eine Irreführung vorliegt und schränkt demnach das allgemeine Irreführungsverbot des § 2 UWG keineswegs ein (RIS‑Justiz RS0118492). Auch bei der Prüfung der irreführenden Arzneimittelwerbung sind die Grundsätze der zu § 2 UWG entwickelten irreführenden Geschäftspraktik anzuwenden. Auch die von der klagenden Partei angeführten Bestimmungen des Pharming Verhaltenskodex normieren keine Vorgaben, die über das Irreführungsgebot hinausgehen (vgl Dieners in Dieners, Handbuch Compliance im Gesundheitswesen³, Rz 65), weshalb darüber eine nähere Erörterung unterbleiben kann. In erster Linie ist daher zu prüfen, ob die Werbeankündigungen der beklagten Partei gegen § 2 UWG verstoßen (vgl 4 Ob 391/87); dies ist nicht der Fall.
1.1.3. Grundsätzlich kann auch eine Angabe trotz sachlicher Richtigkeit irreführend im Sinn des § 2 UWG sein, wenn ihr etwas Unwahres entnommen werden kann, wobei es auf die Verkehrsauffassung und auf den Gesamteindruck der Mitteilung ankommt (RIS‑Justiz RS0078470). Ein solcher unrichtiger Eindruck kann auch dann entstehen, wenn der Werbende etwas Selbstverständliches betont und damit auf Umstände hinweist, die bei allen Wettbewerbern und allen Konkurrenzerzeugnissen vorliegen müssen. Voraussetzung dafür ist somit, dass die Werbung einen selbstverständlichen Umstand in einer Weise betont, dass die angesprochenen Verkehrskreise eine besondere Leistung gerade nur des – mit dem vermeintlichen Vorteil werbenden – Unternehmens annehmen (RS0078470 [T21, T28]). Entscheidend für die Annahme eines Wettbewerbsverstoßes ist in solchen Fällen somit, dass durch die in der Ankündigung erfolgte Betonung eines solchen selbstverständlichen Umstands eine Irreführung der angesprochenen Verkehrskreise erfolgt (4 Ob 198/03a; 4 Ob 121/10p). Auch bei Betonen einer Eigenschaft fehlt der irreführende Charakter daher, wenn der Verkehr erkennt, dass es sich dabei ohnehin um etwas Selbstverständliches handelt (Anderl/Appl in Wiebe/Kodek, UWG2 § 2 UWG Rz 202; Bornkamm/Feddersen in Köhler/Bornkamm UWG37 § 5 Rz 1.113).
1.1.4. Entgegen der Auffassung des Rekursgerichts wird das angesprochene Fachpublikum bei der kombinierten Aussage „wirksam und verträglich“ nicht auf eine deutlich bessere Wirkung bzw auf einen Ausschluss jeglicher Nebenwirkungen schließen. Neben der erkennbaren Selbstverständlichkeit, dass ein Arzneimittel wirksam ist, werden die Adressaten die Ankündigung vielmehr dahin verstehen, dass die beworbenen Arzneimittel im Rahmen des Üblichen auch verträglich sind, das heißt, die Nebenwirkungen beeinträchtigen (mangels außergewöhnlicher Nebenwirkungen und Gegenanzeigen) das normale (unbeschwerte) Lebensgefühl und den alltäglichen Lebensvollzug nicht. Die angesprochenen Verkehrskreise werden weder annehmen, sie könnten die beworbenen Eigenschaften allein bei der beklagten Partei beziehen, noch aus der Werbung ein absolutes Wirksamkeitsversprechen oder einen Hinweis auf völlige Freiheit von Nebenwirkungen ableiten. Die Aussage „wirksam und verträglich“ verstößt daher nicht gegen § 6 Abs 3 Z 1 und 2 AMG bzw § 2 UWG; eine irreführende Geschäftspraktik liegt nicht vor.
1.2. Mit der gerügten Werbeaussage wird somit nicht im Sinne des Klagsvorbringens suggeriert, dass ein Erfolg regelmäßig zu erwarten und Nebenwirkungen stets auszuschließen sind. Der Vorwurf, die so verstandene Information sei unvollständig oder nicht ausreichend belegt, kann daher das Begehren nicht stützen.
1.3. Der Sicherungsantrag kann auch nicht mit einem Verstoß gegen § 50a AMG begründet werden.
Diese Norm lautet:
§ 50a. [...]
(3) Werbung für Arzneimittel muss die Eigenschaften der Arzneispezialität objektiv und ohne Übertreibung darstellen und darf weder Aussagen noch bildliche Darstellungen enthalten, die
1. dem Arzneimittel eine über seine tatsächliche Wirkung hinausgehende Wirkung beilegen,
2. fälschlich den Eindruck erwecken, dass ein Erfolg regelmäßig erwartet werden kann, oder
3. nicht mit Kennzeichnung, Gebrauchs- oder Fachinformation (Zusammenfassung der Produkteigenschaften – SmPC) vereinbar sind.
[...]
Bezüglich der gerügten Irreführung entsprechen § 50a Abs 3 Z 1 und 2 AMG im Wesentlichen den oben besprochenen Bestimmungen des § 6 Abs 3 Z 1 und 2 AMG, sodass für § 50a Abs 3 Z 1 und 2 AMG für die Frage der Irreführung im Anlassfall kein gesonderter Anwendungsbereich verbleibt. Der vom Rekursgericht wegen des Widerspruchs zu den Fachinformationen (vgl § 50a Abs 3 Z 3 AMG) bejahte Verstoß gegen das Objektivitätsgebot betrifft die Fallgruppe Wettbewerbsvorsprung durch Rechtsbruch (vgl 4 Ob 174/07b; 4 Ob 161/16d). Allerdings hat sich die Prüfung eines Rechtsbruchs auf die im Sachvorbringen der klagenden Partei genannten Verbotsnormen zu beschränken (RIS‑Justiz RS0129497). Ein Verstoß gegen § 50a Abs 3 Z 3 AMG wurde von der klagenden Partei aber gar nicht geltend gemacht.
2. Auch die Aussage „auf Herz und Nieren geprüft“ begründet keinen lauterkeitsrechtlichen Unterlassungsanspruch.
2.1. Ihr liegt der objektive Umstand zugrunde, dass die beworbenen Arzneimittel intensiv und erfolgreich im Hinblick auf ihre Auswirkungen auf Herz (kardiovaskuläre Ergebnisse) und Niere (Nierenerkrankungen etc) wissenschaftlich überprüft wurden. Auch das Berufungsgericht ging zutreffend von einem möglichen Verständnis der angesprochenen Fachkreise dahin aus, dass die Medikamente gezielt und intensiv mit positiven Ergebnissen auf ihre Wirkungen auf Herz und Niere untersucht wurden. Dieser von der beklagten Partei erweckte Eindruck entspricht allerdings den Tatsachen und verstößt nicht gegen das Irreführungsgebot. Aus der Aussage ist nicht abzuleiten, dass bei dieser Medizin ein Erfolg mit Sicherheit zu erwarten ist oder keine schädlichen Wirkungen eintreten.
2.2. Aus diesen Erwägungen kann im gerügten Hinweis keine marktschreierische Aussage und damit kein Verstoß gegen das Objektivitätsgebot erblickt werden.
2.3.1. Aufgrund des wissenschaftlichen Nachweises der Werbeaussage „auf Herz und Nieren geprüft“ geht auch der darauf abzielende Unterlassungsanspruch, der beklagten Partei möge untersagt werden, diese Aussage ohne ausreichenden Beleg zu tätigen, ins Leere. Insoweit die klagende Partei und das Rekursgericht davon ausgehen, dass der Werbefolder nicht ausreichend auf die Studie Bezug nimmt, wird dabei der beklagten Partei aber keine irreführende Geschäftspraktik, sondern ein Verstoß gegen Vorschriften vorgeworfen, die eine ausreichende Referenzierung vorschreiben.
2.3.2. Diesbezüglich kann der Unterlassungsanspruch im Ergebnis aber auch nicht auf einen Verstoß gegen § 55 Abs 2 und Abs 4 AMG gestützt werden.
§ 55. (1) Alle Unterlagen über eine Arzneispezialität, die im Rahmen der Verkaufsförderung für diese Arzneispezialität an die zur Verschreibung oder Abgabe berechtigten Personen abgegeben werden, müssen neben den in § 54 Abs. 1 genannten Informationen die Angabe des Zeitpunkts, zu dem die Unterlagen erstellt oder zuletzt geändert worden sind, enthalten.
(2) Alle in den in Abs. 1 erwähnten Unterlagen enthaltenen Informationen müssen genau, aktuell, überprüfbar und vollständig genug sein, um dem Empfänger die Möglichkeit zu geben, sich persönlich ein Bild von dem therapeutischen Wert des Arzneimittels zu machen.
(3) Die aus der Fachliteratur entnommenen Zitate, Tabellen und sonstigen Darstellungen, die in den in Abs. 1 genannten Unterlagen verwendet werden, müssen wortgetreu übernommen werden; dabei ist die genaue Quelle anzugeben.
(4) Wird in den in Abs. 1 genannten Unterlagen auf Fachliteratur Bezug genommen, so ist deren wesentlicher Inhalt mit Quellenangabe objektiv wiederzugeben.
Auch bei einem Verstoß gegen diese Normen ist eine auf wissenschaftlichen Erkenntnissen beruhende, den Tatsachen entsprechende Behauptung nicht deshalb irreführend, weil der Adressat die Quelle nicht nachprüfen kann. Denkbar ist allenfalls ein unlauterer Wettbewerbsvorsprung durch Rechtsbruch. Allerdings konnte die beklagte Partei zumindest in vertretbarer Weise davon ausgehen, dass mit der namentlichen Nennung der in Fachkreisen bekannten Studie und der Abbildung des Studienlogos im Folder eine ausreichende Referenz auf die wissenschaftliche Studie erfolgt ist, die der Aussage „auf Herz und Nieren geprüft“ zugrundeliegt. Dies auch unter Berücksichtigung des Umstands, dass die den zitierten Bestimmungen des AMG zugrundeliegende Richtlinie 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel in Art 92 die Anführung einer genauen Quelle nur bei den aus medizinischen Zeitschriften oder wissenschaftlichen Werken entnommenen Zitaten, Tabellen und sonstigen Illustrationen, nicht aber bei einer bloßen Bezugnahme auf eine Studie verlangt.
Dem Revisionsrekurs war daher Folge zu geben und die Entscheidung des Erstgerichts wiederherzustellen.
Die Entscheidung über die Kosten des Rechtsmittelverfahrens beruht auf §§ 41, 50 ZPO iVm § 393 Abs 1 EO.
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)