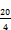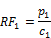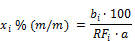Anlage 37
NACHWEIS UND BESTIMMUNG VON HYDROCHINON, HYDROCHINONMONOMETHYLETHER, HYDROCHINONMONOETHYLETHER UND HYDROCHINONMONOBENZYLETHER IN KOSMETISCHEN MITTELN
- A. NACHWEIS
- 1. Zweck und Anwendungsbereich
Diese Methode beschreibt ein Verfahren zum Nachweis von Hydrochinon, Hydrochinonmonomethylether, Hydrochinonmonoethylether und Hydrochinonmonobenzylether (Monobenzon) in kosmetischen Mitteln zur Aufhellung der Haut (Hautbleichmittel)
- 2. Kurzbeschreibung
Hydrochinon und seine Ether werden mittels Dünnschichtchromatographie (DC) nachgewiesen.
- 3. Reagenzien
Alle Reagenzien müssen analysenrein sein.
- 3.1. Ethanol, 96% (V/V)
- 3.2. Chloroform
Warnung:
Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Einatmen und durch Verschlucken. Reizt die Haut. Irreversibler Schaden möglich.
Hinweis:
Chloroform kann ohne Beeinflussung der Trennleistung des chromatographischen Systems durch Dichlormethan ersetzt werden.
- 3.3. Diethylether
- 3.4. Fließmittel: Chloroform/Diethylether, 66 + 33 (V + V)
- 3.5. Ammoniak-Lösung, 25% (m/m)
- 3.6. Ascorbinsäure
- 3.7. Hydrochinon
- 3.8. Hydrochinonmonomethylether
- 3.9. Hydrochinonmonoethylether
- 3.10. Hydrochinonmonobenzylether (Monobenzon)
- 3.11. Vergleichslösungen
Die Vergleichslösungen sind frisch herzustellen; sie sind einen Tag lang haltbar.
- 3.11.1. 0,05 g Hydrochinon (3.7) werden in ein graduiertes 10-ml-Reagenzglas eingewogen. Nach Zusatz von 0,25 g Ascorbinsäure (3.6) und 5 ml Ethanol (3.1) wird die Mischung mit Ammoniaklösung (3.5) auf einen pH-Wert von 10 eingestellt. Anschließend wird die Mischung mit Ethanol (3.1) zu 10 ml aufgefüllt.
- 3.11.2. 0,05 g Hydrochinonmonomethylether (3.8) werden in ein graduiertes 10-ml-Reagenzglas eingewogen. Nach Zusatz von 0,25 g Ascorbinsäure (3.6) und 5 ml Ethanol (3.1) wird die Mischung mit Ammoniaklösung (3.5) auf einen pH-Wert von 10 eingestellt. Anschließend wird die Mischung mit Ethanol (3.1) zu 10 ml aufgefüllt.
- 3.11.3. 0,05 g Hydrochinonmonoethylether (3.9) werden in ein graduiertes 10-ml-Reagenzglas eingewogen. Nach Zusatz von 0,25 g Ascorbinsäure (3.6) und 5 ml Ethanol (3.1) wird die Mischung mit Ammoniaklösung (3.5) auf einen pH-Wert von 10 eingestellt. Anschließend wird die Mischung mit Ethanol (3.1) zu 10 ml aufgefüllt.
- 3.11.4. 0,05 g Hydrochinonmonobenzylether (3.10) werden in ein graduiertes 10-ml-Reagenzglas eingewogen. Nach Zusatz von 0,25 g Ascorbinsäure (3.6) und 5 ml Ethanol (3.1) wird die Mischung mit Ammoniaklösung (3.5) auf einen pH-Wert von 10 eingestellt. Anschließend wird die Mischung mit Ethanol (3.1) zu 10 ml aufgefüllt.
- 3.12. Silbernitrat
- 3.13. 12-Molybdatophosphorsäure
- 3.14. Kaliumhexacyanoferrat (III)
- 3.15. Eisen (III)-chlorid-hexahydrat
- 3.16. Sprühreagenzien
- 3.16.1. Einer 5%igen (m/V) wäßrigen Lösung von Silbernitrat (3.12) wird Ammoniak-Lösung (3.5) hinzugefügt, bis sich der gebildete Niederschlag wieder auflöst.
Warnhinweis:
Bei längerem Stehen bilden sich explosive Verbindungen. Die Lösung ist daher nach Gebrauch zu verwerfen.
- 3.16.2. 10%ige (m/V) Lösung von 12-Molybdatophosphorsäure (3.13) in Ethanol (3.1).
- 3.16.3. Lösung 1: 1%ige (m/V) wäßrige Lösung von Kaliumhexacyanoferrat (III) (3.14)
Lösung 2: 2%ige (m/V) wäßrige Lösung von Eisen (III)-chlorid (3.15)
Unmittelbar vor Gebrauch werden gleiche Volumina der Lösungen 1 und 2 gemischt.
- 4. Geräte
Normale Laborausstattung und
- 4.1. Übliche Ausrüstung zur Dünnschichtchromatographie
- 4.2. DC-Fertigplatten (200 mm x 200 mm)
Sorbensschicht: | Kieselgel 60 mit Fluoreszenzindikator 254 nm |
Schichtdecke: 0,25 mm | |
- 4.3. Ultraschallbad
- 4.4. Zentrifuge
- 4.5. UV-Lampe, Wellenlänge 254 nm
- 5. Durchführung
- 5.1. Vorbereitung der Probe
3,0 g der Probe werden in ein graduiertes 10-ml-Reagenzglas eingewogen. Nach Zusatz von 0,25 g Ascorbinsäure (3.6) und 5 ml Ethanol (3.1) wird die Mischung mit Ammoniaklösung (3.5) auf einen pH-Wert von 10 eingestellt. Anschließend wird die Mischung mit Ethanol (3.1) zu 10 ml aufgefüllt. Das Reagenzglas wird verschlossen und der Inhalt im Ultraschallbad 10 min homogenisiert. Die Mischung wird durch ein Papierfilter filtriert oder bei 3 000 U/min zentrifugiert.
- 5.2. Dünnschichtchromatographie
- 5.2.1. Die Chromatographiekammer wird mit dem Fließmittel (3.4) gesättigt.
- 5.2.2. Je 2
l der Vergleichslösungen (3.11) und 2
l der Probelösung (5.1) werden auf die Dünnschichtplatte aufgetragen. Die Dünnschichtplatte wird bei Raumtemperatur und unter Lichtschutz bis zu einer Höhe von 150 mm entwickelt.
- 5.2.3. Die Dünnschichtplatte wird der Kammer entnommen und bei Raumtemperatur aufbewahrt, bis das Fließmittel verdunstet ist.
- 5.3. Detektion
- 5.3.1. Die Dünnschichtplatte wird im ultravioletten Licht der Wellenlänge 254 nm betrachtet; die Flecke werden markiert.
- 5.3.2. Anschließend wird die Dünnschichtplatte besprüht entweder mit
- dem Silbernitrat-Reagenz (3.16.1) oder
- dem 12-Molybdatophosphorsäure-Reagenz (3.16.2) und auf etwa 120 °C erhitzt oder
- der Mischung aus Kaliumhexacyanoferrat(III)-Lösung und Eisen(III)-chlorid-Lösung (3.16.3).
- 6. Auswertung
Der Rf-Wert wird für jeden Fleck berechnet.
Die für die Probelösung erhaltenen Flecke werden mit denen der Vergleichslösungen im Hinblick auf ihre Rf-Werte, die Farbe der Flecke im UV-Licht und die Farben der Flecke nach Sichtbarmachung mit dem Sprühreagenz verglichen. Man führt die im folgenden Abschnitt B beschriebene HPLC durch und vergleicht die Retentionszeiten der Probenpeaks mit denen der Vergleichslösungen.
Der Nachweis von Hydrochinon und seiner Ether wird durch Kombination der Ergebnisse der DC und der HPLC geführt.
- 7. Bemerkungen
Unter den angegebenen Bedingungen wurden folgende Rf-Werte ermittelt:
Hydrochinon | 0,32 |
Hydrochinonmonomethylether | 0,53 |
Hydrochinonmonoethylether | 0,55 |
Hydrochinonmonobenzylether | 0,58 |
- B. BESTIMMUNG
- 1. Zweck und Anwendungsbereich
Diese Methode beschreibt ein Verfahren zur Bestimmung von Hydrochinon, Hydrochinonmonomethylether, Hydrochinonmonoethylether und Hydrochinonmonobenzylether (Monobenzon) in kosmetischen Mitteln zur Aufhellung der Haut (Hautbleichmittel).
- 2. Kurzbeschreibung
Die Probe wird mit einer Wasser/Methanol-Mischung extrahiert, wobei durch schwaches Erwärmen das Schmelzen etwaig vorhandener Fette gewährleistet wird. Die Bestimmung der Analyten im Extrakt erfolgt durch Hochleistungsflüssigkeitschromatographie mit reverser Phase und UV-Detektion.
- 3. Reagenzien
- 3.1. Alle Reagenzien müssen analysenrein sein. Wasser muß destilliert sein oder zumindest gleichwertige Reinheit aufweisen.
- 3.2. Methanol
- 3.3. Hydrochinon
- 3.4. Hydrochinonmonomethylether
- 3.5. Hydrochinonmonoethylether
- 3.6. Hydrochinonmonobenzylether (Monobenzon)
- 3.7. Tetrahydrofuran für die HPLC
- 3.8. Wasser/Methanol-Mischung 1 + 1 (V + V): 1 Volumenteil Wasser und 1 Volumenteil Methanol (3.2) werden gemischt.
- 3.9. Mobile Phase: Tetrahydrofuran/Wasser-Mischung 45 + 55 (V + V): 45 Volumenteile Tetrahydrofuran (3.7) und 55 Volumenteile Wasser werden gemischt.
- 3.10. Standardlösung
0,06 g Hydrochinon (3.3), 0,08 g Hydrochinonmonomethylether (3.4), 0,10 g Hydrochinonmonoethylether (3.5) und 0,12 g Hydrochinonmonobenzylether (3.6) werden in einen 50-ml-Meßkolben genau eingewogen, in Methanol (3.2) gelöst und anschließend mit Methanol zur Marke aufgefüllt. 10,00 ml dieser Stammlösung werden mit der Wasser/Methanol-Mischung (3.8) zu 50,00 ml verdünnt.
Die Lösungen sind frisch herzustellen.
- 4. Geräte
Normale Laborausstattung und
- 4.1. Wasserbad, auf 60 °C konstant einstellbar
- 4.2. Hochleistungsflüssigkeitschromatograph mit UV-Detektor mit variabler Wellenlänge und mit 10
l-Probenschleife
- 4.3. Analytische Trennsäule
Material: Edelstahl
Länge: 25 cm
Innendurchmesser: 4,6 mm
Aktiver Festkörper: Zorbax Phenyl (6
m) oder gleichwertiges Erzeugnis (mit Phenylalkylgruppen modifiziertes Kieselgel und end-capped mit Trimethylchlorsilan)
Falls eine Vorsäule verwendet wird, muß sie die gleichen Eigenschaften wie die Trennsäule besitzen.
- 4.4. Papierfilter, Durchmesser 90 mm (Schleicher und Schüll, Weißband Nr. 5892, oder gleichwertiges Erzeugnis)
- 5. Durchführung
- 5.1. Vorbereitung der Probe
1 g
0,1 g (a Gramm) der Probe wird auf drei Dezimalstellen genau in einen 50-ml-Meßkolben eingewogen. Nach Zusatz von 25 ml der Wasser/Methanol-Mischung (3.8) wird der verschlossene Kolben mindestens 1 Minute kräftig geschüttelt, bis eine homogene Suspension erhalten wird. Zur Verbesserung der Extraktion wird der Kolben im Wasserbad (4.1) auf 60 °C erwärmt. Nach dem Abkühlen wird mit der Wasser/Methanol-Mischung (3.8) zur Marke aufgefüllt. Die Mischung wird durch ein Papierfilter (4.4) filtriert. Die HPLC-Bestimmung ist innerhalb von 24 Stunden nach Herstellung der Probelösung durchzuführen.
- 5.2. Hochleistungsflüssigkeitschromatographie
- 5.2.1. Bedingungen für die Chromatographie
Volumenstrom der mobilen Phase (3.9): 1,0 ml/min
Detektionswellenlänge: 295 nm
- 5.2.2. 10
l der Probelösung (5.1) werden chromatographiert, das Chromatogramm aufgezeichnet und die Peakflächen ermittelt.
Die Kalibrierung wird, wie unter 5.2.3 beschrieben, durchgeführt.
Die Chromatogramme der Probe- und der Standardlösung werden verglichen.
Unter Verwendung der Peakflächen und des gemäß Abschnitt 5.2.3 ermittelten Responsefaktors (RF) wird der Gehalt der Analyten in der Probelösung berechnet.
- 5.2.3. Kalibrierung
10
l der Standardlösung (3.10) werden chromatographiert, das Chromatogramm aufgezeichnet und die Peakflächen ermittelt.
Die Wiederholbarkeit des Meßsignals wird durch wiederholtes Chromatographieren überprüft.
Der Responsefaktor RFi,wird wie folgt berechnet:
pi = | Peakfläche für Hydrochinon, Hydrochinonmonomethylether, Hydrochinonmonoethylether oder Hydrochinonmonobenzylether |
ci = | Konzentration (g/50 ml) von Hydrochinon, Hydrochinonmonomethylether, Hydrochinonmonoethylether oder Hydrochinonmonobenzylether in der Standardlösung (3.10) |
Die Chromatogramme der Standardlösung und der Probelösung sollen folgende Bedingungen erfüllen:
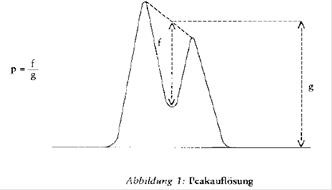
- Peakauflösung: Die Peakauflösung soll mindestens 0,90 betragen (zur Definition der Peakauflösung siehe Abbildung 1).
Falls die erforderliche Auflösung nicht erreicht wird, verwendet man entweder eine leistungsfähigere Säule oder verändert die Zusammensetzung der mobilen Phase, bis die Bedingung erfüllt ist.
- Peakasymmetrie: Der Asymmetriefaktor AS soll zwischen 0,9 und 1,5 liegen (zur Definition des Asymmetriefaktors siehe Abbildung 2). Bei der Aufzeichnung des Chromatogramms zur Bestimmung der Peakasymmetrie sollte der Papiervorschub mindestens 2 cm/min betragen.
- Basislinie: Die Basislinie sollte stabil sein.
- 6. Berechnung
Der Gehalt des/der Analyten in Prozent (xi) der Probe wird anhand der Peakflächen nach folgender Formel berechnet:
a | = | Einwaage der untersuchten Probe in Gramm |
bi | = | Peakfläche des Analyten i in der Probelösung |
RFi | = | Responsefaktor nach 5.2.3 |
- 7. Wiederholbarkeit (1)
- 7.1. Bei einem Hydrochinongehalt von 2,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe parallel durchgeführter Bestimmungen um nicht mehr als 0,13% (m/m) voneinander abweichen.
- 7.2. Bei einem Hydrochinonmonomethylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe parallel durchgeführter Bestimmungen um nicht mehr als 0,1% (m/m) voneinander abweichen.
- 7.3. Bei einem Hydrochinonmonoethylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe parallel durchgeführter Bestimmungen um nicht mehr als 0,11% (m/m) voneinander abweichen.
- 7.4. Bei einem Hydrochinonmonobenzylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe parallel durchgeführter Bestimmungen um nicht mehr als 0,11% (m/m) voneinander abweichen.
- 8. Vergleichbarkeit (1)
- 8.1. Bei einem Hydrochinongehalt von 2,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe unter Vergleichsbedingungen (verschiedene Laboratorien, verschiedene Bearbeiter, verschiedene Geräteausrüstung) durchgeführter Bestimmungen um nicht mehr als 0,37% (m/m) voneinander abweichen.
- 8.2. Bei einem Hydrochinonmonomethylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe unter Vergleichsbedingungen (verschiedene Laboratorien, verschiedene Bearbeiter, verschiedene Geräteausrüstung) durchgeführter Bestimmungen um nicht mehr als 0,21% (m/m) voneinander abweichen.
- 8.3. Bei einem Hydrochinonmonoethylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe unter Vergleichsbedingungen (verschiedene Laboratorien, verschiedene Bearbeiter, verschiedene Geräteausrüstung) durchgeführter Bestimmungen um nicht mehr als 0,19% (m/m) voneinander abweichen.
- 8.4. Bei einem Hydrochinonmonobenzylethergehalt von 1,0% (m/m) dürfen die Ergebnisse zweier an derselben Probe unter Vergleichsbedingungen (verschiedene Laboratorien, verschiedene Bearbeiter, verschiedene Geräteausrüstung) durchgeführter Bestimmungen um nicht mehr als 0,11% (m/m) voneinander abweichen.
- 9. Bemerkungen
- 9.1. Wenn ein wesentlich höherer Hydrochinongehalt als 2% (m/m) ermittelt wird und eine genaue Gehaltsbestimmung erforderlich ist, sollte die Probelösung (5.1) auf einen ähnlichen Gehalt verdünnt werden, wie er sich bei einer 2% Hydrochinon enthaltenden Probe ergeben würde, und die Bestimmung ist zu wiederholen.
(Bei hohen Hydrochinongehalten kann die Absorption außerhalb des linearen Bereiches des Detektors liegen.)
- 9.2. Störeinflüsse
Die beschriebene Methode ermöglicht die Bestimmung von Hydrochinon und seinen Ethern in einem einzigen isokratischen Lauf. Die Verwendung einer Phenylsäule gewährleistet eine hinreichende Retention für Hydrochinon, was bei Benutzung einer C 18-Säule mit der beschriebenen mobilen Phase nicht garantiert werden kann.
Diese Methode unterliegt jedoch möglicherweise den Störeinflüssen durch eine Reihe von p-Hydroxybenzoesäureestern (Parabene). In diesen Fällen ist die Bestimmung unter Verwendung eines anderen Trennsystems (stationäre und mobile Phase) zu wiederholen. Geeignete Methoden sind (siehe die in den Fußnoten 1 und 2 angegebene Literatur):
Analytische Trennsäule (2) : 4,6 mm x 25 cm | ||
Aktiver Festkörper: | Mit Octadecylgruppen modifiziertes Kieselgel (Zorbax ODS oder gleichwertiges Erzeugnis) | |
Temperatur: 36 °C | ||
Volumenstrom der mobilen Phase: 1,5 ml/min | ||
Mobile Phase: | für Hydrochinon Methanol/Wasser 5 + 95 (V + V) | |
für Hydrochinonmonomethylether: Methanol/Wasser 30 + 70 (V + V) | ||
für Hydrochinonmonobenzylether: Methanol/Wasser 80 + 20 (V + V) | ||
Analytische Trennsäule (3): | ||
Aktiver Festkörper: | Mit Octadecylgruppen modifiziertes Kieselgel (Spherisorb S5-ODS oder gleichwertiges Erzeugnis) | |
Volumenstrom der mobilen Phase: 1,5 ml/min | ||
Mobile Phase: Wasser/Methanol 90 + 10 (V + V) | ||
Diese Bedingungen eignen sich für Hydrochinon. | ||
___________
(1) ISO 5725
(2) M. Herpol-Borremans und M. O. Masse, Indentification et dosage de l'hydroquinone et ses ethers methylique et benzylique dans les produits cosmethiques pour blanchir la peau, Int. J. Cosmet. Sci 8 – 203-214 (1986).
(3) J. Firth und I. Rix, Determination of Hydroquinone in skin toning creams, Analyst (1986), 111, S. 129.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12139955
alte Dokumentnummer
N8199658337J
Zusatzdokumente: image001, image002, image003, image004, image005, image006, image007
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)