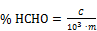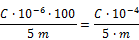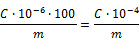Anlage 11
NACHWEIS UND QUANTITATIVE BESTIMMUNG DES FREIEN FORMALDEHYDS
- 1. ANWENDUNGSBEREICH Die Methode beschreibt den qualitativen Nachweis und die quantitative Bestimmung des Formaldehyds in allen kosmetischen Erzeugnissen; sie umfaßt drei Teile:
- 1.1. Nachweis
- 1.2. Bestimmung der Gesamtmenge durch Kolorimetrie mit Pentan-2,4-Dion (Acetylaceton):
Diese Methode ist anwendbar, wenn das Formaldehyd einzeln oder mit anderen Konservierungsstoffen, die kein Formaldehyd abspalten, verwendet wird.
Im gegenteiligen Fall und falls das Ergebnis die im Fertigerzeugnis zulässige Höchstkonzentration übersteigt, ist die folgende Methode zur Bestätigung anzuwenden:
- 1.3. Quantitative Bestimmung bei Anwesenheit von Formaldehyd-abspaltenden Stoffen:
Zunächst ist das freie Formaldehyd vom gebundenen oder polymerisierten Formaldehyd durch Flüssigkeitschromatografie zu trennen. Anschließend ist die Menge nach der vorstehend beschriebenen Methode durch Kolorimetrie zu bestimmen.
- 2. BEGRIFFSBESTIMMUNG
Der nach dieser Methode bestimmte Gehalt der Probe an freiem Formaldehyd, ist in Prozent (m/m) anzugeben.
- 3. NACHWEIS DES FREIEN UND GEBUNDENEN FORMALDEHYDS
- 3.1. Prinzip
Freies und gebundenes Formaldehyd ergeben in schwefelsaurem Milieu in Anwesenheit von Schiffs-Reagenz eine rosa oder lila Färbung.
- 3.2. Reagenzien
Es sind analysenreine Reagenzien zu verwenden.
- 3.2.1. Fuchsin
- 3.2.2. Natriumsulfithydrat mit 7 H2O
- 3.2.3. Konzentrierte Chlorwasserstoffsäure (d = 1,19)
- 3.2.4. Schwefelsäure, etwa 2 n
- 3.2.5. Schiffs-Reagenz
In ein Becherglas 100 mg Fuchsin (3.2.1) einwiegen und mit 75 ml auf 80 °C erwärmtem Wasser auflösen. Nach dem Abkühlen 2,5 g Natriumsulfit (3.2.2) und 1,5 ml Chlorwasserstoffsäure (3.2.3) hinzugeben, auf 100 ml auffüllen. Aufbewahrung 2 Wochen.
- 3.3. Durchführung
- 3.3.1. In ein 10ml-Becherglas ca. 2 g der Probe einfüllen.
- 3.3.2. Zwei Tropfen H2SO4 (3.2.4) und 2 ml Schiffs-Reagenz (3.2.5) hinzufügen. Dieses Reagenz muß zum Zeitpunkt der Anwendung absolut farblos sein. Schütteln, 5 Minuten stehenlassen.
- 3.3.3. Wird nach 5 Minuten eine rosa oder lila Färbung festgestellt, so liegt die enthaltene Formaldehydmenge über 0,01 %.
Das freie und gebundene Formaldehyd ist nach Punkt 4 und, wenn nötig, nach Punkt 5 quantitativ zu bestimmen.
- 4. BESTIMMUNG DER GESAMTMENGE DURCH KOLORIMETRIE MIT PENTAN-2,4-DION (ACETYLACETON)
- 4.1. Prinzip
Das Formaldehyd reagiert mit Pentan-2,4-dion in Anwesenheit von Ammoniumacetat unter Bildung von 3,5-Diacetyl-1,4-Dihydrolutidin. Dieses ist mit 1-Butanol zu extrahieren und die Absorption bei 410 nm zu messen.
- 4.2. Reagenzien
Es sind analysenreine Reagenzien zu verwenden.
- 4.2.1. Ammoniumacetat, wasserfrei
- 4.2.2. Konzentrierte Essigsäure
- 4.2.3. Frisch unter vermindertem Druck 25 mm Hg25° destilliertes Pentan-2,4-dion (Acetylaceton), das bei 410 nm keinerlei Absorption ergeben darf.
- 4.2.4. 1-Butanol
- 4.2.5. n-Chlorwasserstoffsäure
- 4.2.6. Chlorwasserstoffsäure, etwa 0,1 n
- 4.2.7. n-Natriumhydroxid
- 4.2.8. Stärkelösung, frisch hergestellt nach Ph. Eur., (1 g/50 ml Wasser). Zweite Ausgabe 1980, Teil I-VII-1-1.
- 4.2.9. Formaldehyd, 37-40 %ig
- 4.2.10. 0,1-n-Jodlösung (genau eingestellt).
- 4.2.11. 0,1-n-Natriumthiosulfatlösung (genau eingestellt).
- 4.2.12. Acetylaceton-Reagenz
In einem 1 000-ml Meßkolben lösen
- 150 g Ammoniumacetat (4.2.1),
- 2 ml Acetylaceton (4.2.3),
- 3 ml Essigsäure (4.2.2).
Mit Wasser (pH der Lösung etwa 6,4) auf 1 000 ml auffüllen.
Dieses Reagenz ist stets frisch herzustellen.
- 4.2.13. Reagenz (4.2.12) ohne Acetylaceton.
- 4.2.14. Formaldehyd-Stammlösung
In eine 1 000 ml-Meßflasche 5 g Formaldehyd (4.2.9) eingeben und auf 1 000 ml auffüllen.
Bestimmung des Gehalts dieser Lösung: Hierzu 10,00 ml entnehmen, 25,00 ml eingestellter Jodlösung (4.2.10) und 10 ml Natriumhydroxidlösung (4.2.7) hinzugeben.
5 Minuten stehenlassen.
11 ml n-HCL (4.2.5) sowie eine Stärkelösung als Indikator hinzugeben und den Überschuß der Jodlösung mittels eingestellter Natriumthiosulfatlösung (4.2.11) titrieren.
Der Verbrauch von 1 ml 0,1-n-Jodlösung entspricht 1,5 ml HCHO.
- 4.2.15. Formaldhyd-(Anm.: richtig: Formaldehyd‑)Vergleichslösung
Mit entmineralisiertem Wasser zuunächst (Anm.: richtig: zunächst) eine Lösung 1 : 20 und hiervon eine Lösung 1 : 100 herstellen.
1 ml dieser Lösung enthält etwa 1
g Formaldehyd.
Der genaue Gehalt ist zu berechnen.
- 4.3. Geräte
- 4.3.1. Übliches Laborgerät.
- 4.3.2. „Phasentrennungs“-Filter WHATMAN 1 PS (oder ein gleichwertiger Filter).
- 4.3.3. Zentrifuge.
- 4.3.4. Wasserbad, 60 °C.
- 4.3.5. Spektrophotometer.
- 4.3.6. 1-cm-Glasküvetten.
- 4.4. Durchführung
- 4.4.1. Probelösung
In einen 100-ml-Meßkolben auf 0,001 g genau eine Probenmenge (in g), die einer vermuteten Menge von etwa 150
HCHO entspricht, einwiegen. Mit entmineralisiertem Wasser auf 100 ml auffüllen (S-Lösung).
(Überprüfen, ob der pH nahe bei 6 liegt, sonst in Chlorwasserstoffsäurelösung (4.2.6) verdünnen).
In einen 50-ml-Erlenmeyerkolben mit der Pipette eingeben
- 10,00 ml der S-Lösung,
- 5,00 ml Pentan-2,4-dion Reagenz (4.2.12), mit entmineralisiertem Wasser auf 30 ml auffüllen.
- 4.4.2. Vergleichslösung
Die eventuelle Interferenz einer Grundfärbung in der Versuchsprobe für den Versuch ist wie folgt zu beseitigen: In einen 50-ml-Erlenmeyerkolben eingeben:
- 10,0 ml S-Lösung,
- 5,0 ml Reagenz (4.2.13), mit entmineralisiertem Wasser auf 30 ml auffüllen.
- 4.4.3. Blindlösung
In einen 50-ml-Erlenmeyerkolben eingeben: 5,0 ml Pentan-2,4-dion-Reagenz (4.2.12) und mit entmineralisiertem Wasser auf 30 ml auffüllen.
- 4.4.4. Quantitative Bestimmung
- 4.4.4.1. Die Erlenmeyerkolben nach 4.4.1, 4.4.2 und 4.4.3 schütteln und 10 Minuten lang in ein Wasserbad von 60 °C eintauchen. Zwei Minuten in einem Kühlbad abkühlen lassen.
- 4.4.4.2. Den Inhalt jeweils in einen 50-ml-Scheidetrichter, der genau 10 ml 1-Butanol (4.2.4) enthält, überführen. Mit 3-5 ml Wasser nachspülen; die Mischung genau 30 Sekunden kräftig schütteln, dann abtrennen.
- 4.4.4.3. Die Butanol-Phase über „Phasentrennungs“ -Filter (4.3.2) in die Meßküvetten filtrieren. Auch das Zentrifugieren (3 000 g, 5 Min. lang) ist möglich.
- 4.4.4.4. Die Absorption A1 der Probenlösung nach (4.4.1) gegen den Extrakt der Vergleichslösung nach (4.4.2) bei 410 nm messen.
- 4.4.4.5. Entsprechend die Absorption A2 der Blindlösung nach (4.4.3) gegen 1-Butanol messen.
Anmerkung: | Sämtliche Arbeitsgänge sind innerhalb von 25 Minuten nach dem Eintauchen des Erlenmeyerkolbens in das 60 °C-Wasserbad durchzuführen. |
- 4.4.5. Eichkurve
- 4.4.5.1. In einen 50-ml-Erlenmeyerkolben eingeben:
- 5,00 ml der verdünnten Stammlösung (4.2.14),
- 5,00 ml Acetylaceton-Reagenz (4.2.12), mit entmineralisiertem Wasser auf 30 ml auffüllen.
- 4.4.5.2. Weiter nach (4.4.4.5) verfahren; die Absorption gegen 1-Butanol (4.2.4) messen.
- 4.4.5.3. Das Verfahren mit 10, 15, 20, 25 ml verdünnter Stammlösung (4.2.14) wiederholen.
- 4.4.5.4. Den Nullwert (entsprechend der Färbung der Reagenzien) wie in (4.4.4.5) bestimmen.
- 4.4.5.5. Die Eichkurve nach Substraktion des Null-Wertes von den Absorptionswerten nach (4.4.5.1) und (4.4.5.3) zeichnen. Das Beersche Gesetz gilt bis 30
g Formaldehyd.
- 4.5. Darstellung der Ergebnisse
- 4.5.1. A2 von A1 abziehen und aus der Eichkurve (4.4.5.5) die in der Lösung (4.4.1) enthaltene und in
g Formaldehyd ausgedrückte Menge C ablesen.
- 4.5.2. Den Formaldehydgehalt der Probe (% m/m) nach folgender Formel berechnen:
- m = Masse der Probenahme in g.
- 4.6. Wiederholbarkeit (1)
Bei einem Formaldehydgehalt von 0,2 % darf die Differenz der Ergebnisse von zwei parallel durchgeführten quantitativen Bestimmungen 0,005 % bei der kolorimetrischen Methode mit Acetylaceton nicht überschreiten.
Falls die Ergebnisse der quantitativen Bestimmung des freien Formaldehyds über den in der Verordnung über das Verbot und die Beschränkung von Stoffen für kosmetische Mittel, BGBl. Nr. 339/1994 i.d.j.g.F., festgelegten Werten liegen, d. h.:
- a) zwischen 0,05 % und 0,2 % bei einem Produkt, bei dem der Formaldehydgehalt nicht auf dem Etikett angegeben ist,
- b) über 0,2 % bei einem Produkt, bei dem der Formaldehydgehalt angegeben bzw. nicht angegeben ist,
ist nach der unter Punkt 5 beschriebenen Methode zu verfahren.
- 5. QUANTITATIVE BESTIMMUNG BEI ANWESENHEIT VON FORMALDEHYD ABSPALTENDEN STOFFEN
- 5.1. Prinzip
Das freie Formaldehyd ist durch Hochleistungsflüssigkeitschromatographie abzutrennen. Um eine Spaltung der HCHO-abspaltenden Stoffe bei der Derivatisierung zu vermeiden, ist vorher eine Flüssigkeitschromatographie durchzuführen; das abgespaltene Formaldehyd ist durch Kettenreaktion mit dem Acetylaceton in einem Nach-Säulen-Reaktor in gelbes Lutidin-Derivat umzuwandeln; das entstandene Derivat ist durch Absorption bei 420 nm nachzuweisen.
- 5.2. Reagenzien
Es sind analysenreine Reagenzien zu verwenden.
- 5.2.1. Baker-Wasser oder Wasser gleichwertiger Qualität.
- 5.2.2. Ammoniumacetat, wasserfrei.
- 5.2.3. Konzentrierte Essigsäure.
- 5.2.4. Acetylaceton (bei 4 °C aufzubewahren).
- 5.2.5. Dinatriumphosphat, wasserfrei.
- 5.2.6. Orthophosphorsäure, 85 % (d = 1,7)
- 5.2.7. Methanol, Spektrographie-Qualität.
- 5.2.8. Dichlormethan, Spektrographie-Qualität.
- 5.2.9. Formaldehyd, 37 – 40 %ig.
- 5.2.10. n-Natriumhydroxid.
- 5.2.11. n-Chlorwasserstoffsäure.
- 5.2.12. 0,002-Chlorwasserstoffsäure.
- 5.2.13. Stärkelösung.
- 5.2.14. 0,1 n-Jodlösung (genau eingestellt).
- 5.2.15. 0,1 n-Natriumthiosulfatlösung (genau eingestellt).
- 5.2.16. Mobile Phase: 0,006 M Dinatriumphosphat (5.2.5) in wässriger Lösung auf pH 2,1 eingestellt mit Orthophosphorsäure (5.2.6).
- 5.2.17. Nach-Säulen-Reagenz
In einem 1 000-ml-Meßkolben lösen:
- 62,6 g Ammoniumacetat (5.2.2),
- 7,5 ml Essigsäure (5.2.3),
- 5 ml Acetylaceton (5.2.4)
Mit Wasser (5.2.1) auf 1 000 ml auffüllen.
Unter Lichtabschluß aufbewahren.
Haltbarkeit: 3 Tage.
- 5.2.18. Formaldehyd-Stammlösung
In eine 1 000-ml-Meßflasche 10 g Formaldehyd (5.2.9) eingeben und auf 1 000 ml auffüllen. Bestimmung des Gehalts dieser Lösung: hierzu 5,00 ml entnehmen, 25 ml eingestellte Jodlösung (5.2.14) und 10 ml Natriumhydroxidlösung (5.2.10) hinzugeben.
Fünf Minuten stehenlassen.
11 ml n-HCL (5.2.11) sowie eine Stärkelösung als Indikaktor hinzugeben und den Überschuß der Jodlösung mittels Natriumthiosulfatlösung (5.2.15) titrieren.
Der Verbrauch von 1 ml 0,1-n-Jodlösung entspricht 1,5 mg Formaldehyd.
- 5.2.19. Formaldehyd-Vergleichslösung
Von der Stammlösung in der mobilen Phase (5.2.16) eine Lösung 1/100 herstellen.
1 ml dieser Lösung enthält etwa 37
g Formaldehyd. Der genaue Gehalt ist zu berechnen.
- 5.3. Geräte
- 5.3.1. Übliches Laborgerät.
- 5.3.2. Eine pulsationsfreie HPLC-Pumpe (Applied Biosystems Pumpe, oder gleichwertige Pumpe)
- 5.3.3. Eine pulsationsfreie Niederdruckpumpe für das Reagenz (oder eine zweite HPLC-Pumpe, wie unter 5.3.2)
- 5.3.4. Ein Einspritzventil mit einer Schleife von 10
l (Valco oder gleichwertiges Einspritzventil)
- 5.3.5. Ein nach-Säulen-Modul (Applied Biosystems PCRS 520 oder gleichwertiges Modul) mit einem 1-ml-Reaktor
oder
Ein 1-l-Kolben mit drei Rohransätzen RIN 3
- 1-l-Kolbenheizgerät
- zwei Vigreux-Kolonnen 10 Böden 2 RIN 3 (luftgekühlt)
- rostfreies Rohr (für den thermischen Austausch) 1,6 mm – Innendurchmesser 0,23 mm, L = 400 mm
- Teflonrohr 1,6 mm – Innendurchmesser 0,30 mm. L = 5 m (siehe Anlage 2)
- 1 T-Stück ohne Totvolumen (Valco oder gleichwertiges T-Stück)
- 3 UNION-Verbindungsstücke ohne Totvolumen.
- 5.3.6. Acrodisch RCR 0,45
Filter (Gelman oder gleichwertiger Filter)
- 5.3.7. SEP PAKRC18-Hülse (Waters oder gleichwertige Hülse)
- 5.3.8. Fertigsäulen:
- Bischoff hypersil RP 18 (Typ NC Bezugsnummer C 25.46 1805)
- 5.3.9. Vorschaltsäule:
- 5.3.10. Säule und Vorschaltsäule sind durch ein ECOTUBE-System (Bezugsnummer A 15020508 Bischoff) oder ein gleichwertiges System zu verbinden.
- 5.3.11. Der Aufbau erfolgt nach dem als Anlage 2 beigefügten Schema.
Die Verbindungsstücke hinter dem Einspritzventil müssen so kurz wie möglich sein.
Bei Verwendung von (5.3.6) dient das rostfreie Rohr zwischen Reaktorausgang und Detektoreingang zur Kühlung des Gemisches vor dem Nachweis.
In diesem Fall ist die in dem Detektor herrschende Temperatur unbekannt aber konstant (Länge und Durchmesser des Rohres konstant, Durchfluß konstant, Temperatur oberhalb konstant 100 °C, konstante Raumtemperatur während der gesamten Zeit der quantitativen Bestimmung).
- 5.3.12. Detektor, UV, sichtbar.
- 5.3.13. Aufzeichnungsgerät.
- 5.3.14. Zentrifuge.
- 5.3.15. Ultraschall-Bad.
- 5.3.16. Vibrationsmischer (Typ Vortex oder gleichwertiger Vibrationsmischer).
- 5.4. Durchführung
- 5.4.1. Eichkurve
Die Standardlösungen werden durch Verdünnung der Formaldehyd-Vergleichslösung (5.2.19) mit der mobilen Phase (5.2.16) hergestellt.
- 1 ml der Standardlösung (5.2.18) verdünnt auf 20 ml (ungefähr 185
g/100 ml),
- 2 ml der Standardlösung (5.2.18) verdünnt auf 20 ml (ungefähr 370
g/100 ml),
- 5 ml der Standardlösung (5.2.18) verdünnt auf 25 ml (ungefähr 740
g/100 ml),
- 5 ml der Standardlösung (5.2.18) verdünnt auf 20 ml (ungefähr 925
g/100 ml).
Die Standardlösungen sind eine Stunde lang bei Labortemperatur aufzubewahren und müssen frisch hergestellt sein.
Die Linearität der Eichkurve gilt für Konzentrationen von 1,0 bis 15
g pro ml.
- 5.4.2. Herstellung der Proben
- 5.4.2.1. Emulsionen (Cremes, Grundierungen, Eyeliner)
In eine Stöpselflasche eine Masse (m) von ungefähr 0,001 g der Versuchsprobe (in g) einwiegen, die einer vermuteten Formaldehydmenge von ungefähr 100
g entspricht.
20 ml Dichlormethan und 20 ml Chlorwasserstoffsäure (5.2.12) genau abgemessen hinzufügen.
Im Vibrationsmischer (5.3.16) und im Ultraschallbad (5.3.15) vermischen.
Die zwei Phasen durch Zentrifugieren (3 000 g in 2 min) trennen.
Eine Hülse (5.3.7) mit 2 ml Methanol (5.2.7) ausspülen, dann mit 5 ml Wasser (5.2.1) konditionieren.
4 ml der wässrigen Phase des Extraktes durch die Hülse (5.3.7) fließen lassen, die ersten zwei ml abgießen und den folgenden Teil auffangen.
- 5.4.2.2. Lotionen, Shampoos
Eine einer vermuteten Formaldehydmenge von ungefähr 500
g entsprechende Masse (m/einer Probe für den Versuch in g) auf 0,001 g genau einwiegen.
Mit der mobilen Phase (5.2.16) auf 100 ml auffüllen.
Die Lösung durch einen Filter (5.3.6) filtrieren und durch eine Hülse (5.3.7), die wie oben vorbereitet wurde, einspritzen bzw. fließen lassen.
Alle Lösungen sind sofort nach der Zubereitung einzuspritzen.
- 5.4.3. Bedingungen für die Chromatographie
- Durchsatz der mobilen Phase : 1 ml pro Minute,
- Durchsatz des Reagenz : 0,5 ml pro Minute,
- Gesamtdurchsatz am Ausgang des Detektors : 1,5 ml pro Minute,
- eingepritzte (Anm.: richtig: eingespritzte) Menge : 10
l
- Eluierungstemperatur : bei schwierigen Trennvorgängen unbedingt 0 °C. Dazu die Säule in Eiswasser eintauchen : Temperaturausgleich abwarten,
- Temperatur bei der nach-Säulen-Reaktion : 100 °C
- Erfassung : 420 nm
Anmerkung: | Das gesamte Chromatographie- und nach-Säulensystem ist nach Gebrauch mit Wasser auszuspülen. Wird das System mehr als zwei Tage nicht benutzt, ist nach dieser Spülung eine Spülung mit Methanol vorzunehmen. Vor einer erneuten Konditionierung des Systems ist mit Wasser zu spülen, um Rekristallisierungen zu vermeiden. |
- 5.5. Berechnung
Emulsionen:
Formaldehydgehalt in % (m/m):
- m = Masse der für die Untersuchung eingesetzten Probemenge in Gramm (5.4.2.1),
- C = aus der Eichkurve (5.4.1) abgelesener Formaldehydgehalt in
g/100 ml.
Lotionen, Shampoos:
Es gilt folgende Formel:
- 5.6. Wiederholbarkeit (1)
Bei einem Formaldehydgehalt von 0,05 % darf die Differenz der Ergebnisse von zwei parallel durchgeführten quantitativen Bestimmungen derselben Probemenge 0,001 % nicht überschreiten. Bei einem Formaldehydgehalt von 0,2 % darf die Differenz der Ergebnisse von zwei parallel durchgeführten quantitativen Bestimmungen derselben Probemenge 0,005 % nicht überschreiten.
Anlage I
ANFERTIGUNG DER „SCHLANGE“
ZUBEHÖR FÜR DIE HERSTELLUNG DER „SCHLANGE“
- 1 Holzspule:
HERSTELLUNG DER „SCHLANGE“
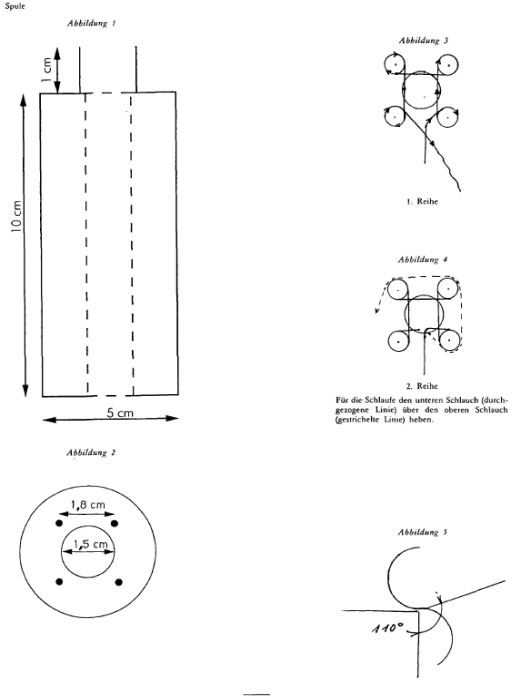
Zu Beginn wird das Teflon-Rohr von oben nach unten in das Mittelloch der Spule geführt (dabei ca. 10 cm des Rohres auf der unteren Seite heraushängen lassen, so daß sich die Kordel während der Herstellung leicht nach unten ziehen läßt), dann für die erste Runde das Rohr um jede der vier Spitzen wickeln (siehe Abbildung 3).
Am Eingang und am Ausgang des Gerätes werden Zwingen und Kompressionsschrauben angebracht, es ist darauf zu achten, daß das Teflon beim Umwickeln nicht beschädigt wird.
Ab der zweiten Reihe wird das Rohr außen um jede Spitze gelegt und dann wie folgt eine Schlaufe gebildet: Mit Hilfe der festen Nadel (siehe Abbildung 4) das Rohr der unteren Reihe über das Rohr der oberen Reihe heben.
Dieser Vorgang ist an jeder der Spitzen unter Einhaltung der Reihenfolge 1 – 2 – 3 – 4 bis zu einer Kordellänge von 5 Metern bzw. bis zur gewünschten Länge zu wiederholen.
Etwa 10 cm des Rohres werden zum Abschluß der Kordel benötigt. Das Rohr durch jede der 4 Schlaufen führen und zum Abschluß der Kordel leicht zusammenziehen.
Anlage II
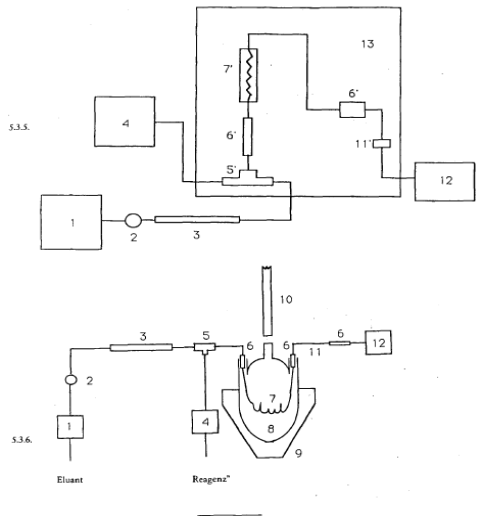
- 1= HPLC-Pumpe (5.3.2.)2= Einspritzventil (5.3.4.)3= Säule mit Vorsäule4= Reagenz-Pumpe (5.3.3.)5= T-Stück ohne Torvolumen5'= T-Stück (Vortex)6-6'= Union-Verbindungsstück ohne Totvolumen7= Strickschlauch7'= Reaktor8= Dreihalskolben mit siedendem Wasser9= Kolbenheizgerät10= Kühler11= Edelstahlkapillare – Wärmeaustauscher11'= Wärmeaustauscher12= Detektor UV/VIS13= Nachsäulen-Modul PCRS 520
______________
(1) Siehe ISO-Norm 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138655
alte Dokumentnummer
N8199547962J
Zusatzdokumente: image001, image002, image003, image004, image005, image006, image007
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)