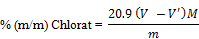Anlage 28
NACHWEIS UND QUANTITATIVE BESTIMMUNG VON ALKALICHLORATEN
ANWENDUNGSBEREICH
Die Methode beschreibt den Nachweis und die Bestimmung von Chloraten in Zahnpasten und anderen kosmetischen Produkten.
A. NACHWEIS
- 1. PRINZIP
Chlorat wird von anderen Halogenaten durch Dünnschichtchromatographie getrennt und durch Oxidation von Kaliumjodid zu Jod nachgewiesen.
- 2. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 2.1. Referenzlösungen: Wässrige Lösungen von
Kalium-Chlorat-Bromat und -Jodat, 0,2 % (m/v), frisch zubereitet.
- 2.2. Fließmittel: Ammoniaklösung 28 % (m/v) – Aceton – Butanol:
60 – 130 – 30 (v/v/v)
- 2.3. Wässrige Kaliumjodidlösung, 5 % (m/v)
- 2.4. Stärkelösung, 1-5 % (m/v)
- 2.5. Salzsäure, 1 M
- 2.6. DC-Fertigplatten Cellulose, Schichtdicke 0,25 mm
- 3. GERÄTE
Übliche Einrichtung für Dünnschichtchromatographie.
- 4. VERFAHREN
- 4.1. Etwa 1 g der Probe wird mit Wasser extrahiert, filtriert und auf etwa 25 ml verdünnt.
- 4.2. 2
l dieser Lösung (4.1) und jeweils 2
l jeder der drei Referenzlösungen (2.1) werden auf die Grundlinie einer DC-Platte (2.6) aufgetragen.
- 4.3. Die DC-Platte in ein Entwicklungsgefäß stellen und mit aufsteigender Chromatographie mit dem Fließmittel (2.2) bis zu etwa drei Viertel der Länge der Platte entwickeln.
- 4.4. Die Platte aus dem Entwicklungsgefäß entfernen und das Fließmittel verdampfen lassen.
Dauer: bis zu 2 Stunden.
- 4.5. Die Platte mit Kaliumjodidlösung (2.3) besprühen und etwa 5 Minuten lang trocknen lassen.
- 4.6. Die Platte mit Stärkelösung (2.4) besprühen und wieder etwa 5 Minuten lang trocknen lassen.
- 4.7. Die Platte mit Salzsäure (2.5) besprühen.
- 5. AUSWERTUNG
Ist Chlorat anwesend, so erscheint nach etwa einer halben Stunde ein blauer (eventuell auch brauner) Fleck mit einem Rf-Wert von ca. 0,7 – 0,8. Bromat und Jodat reagieren sofort.
Halogenat | Rf |
Chlorat | 0,7 – 0,8 |
Bromat | 0,5 – 0,6 |
Jodat | 0 – 0,2 |
Es ist darauf zu achten, daß die Bromat- und Jodatflecken nicht verwechselt werden.
B. QUANTITATIVE BESTIMMUNG
- 1. DEFINITION
Der nach dieser Methode bestimmte Chloratgehalt der Probe wird in Massenprozent (% m/m) Chlorat ausgedrückt.
- 2. PRINZIP
Chlorat wird mit Zinkpulver in saurem Milieu reduziert. Das entstandene Chlorid wird mit Silbernitrat potentiometrisch titriert. Eine analoge Titration vor der Reduktion weist auf die mögliche Anwesenheit von Halogeniden hin.
- 3. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 3.1. Essigsäure, 80 % (m/m)
- 3.2. Zinkpulver
- 3.3. Silbernitratlösung, 0,1 M
- 4. GERÄTE
- 4.1. Übliches Laborgerät
- 4.2. Potentiograph mit Silberindikatorelektrode
- 5. VERFAHREN
- 5.1. Vorbereitung der Probe
Eine Probenmenge m von etwa 2 g wird in ein Zentrifugenglas genau eingewogen. Etwa 15 ml Essigsäure (3.1) hinzugeben und sorgfältig mischen. 30 Minuten reagieren lassen und 15 Minuten lang bei 2 000 U/min zentrifugieren.
Die überstehende Flüssigkeit in einen 50-ml-Meßkolben abgießen und das Zentrifugieren zweimal unter Zugabe von jeweils 15 ml Essigsäure (3.1) zu dem Rückstand wiederholen.
Die Lösungen in dem 50-ml-Meßkolben vereinen und mit Essigsäure (3.1) zum Volumen auffüllen.
- 5.2. Reduktion von Chlorat
20 ml der Lösung 5.1 in einen Rundkolben geben, 0,6 g Zinkpulver (3.2) hinzufügen und am Rückflußkühler zum Sieden bringen. 30 Minuten sieden lassen, abkühlen lassen und das überschüssige Zink abfiltrieren. Den Kolben mit Wasser spülen und damit das Filter nachwaschen. Filtrat und Waschwasser vereinen.
- 5.3. Bestimmung von Chlorid
Die Lösung 5.2 wird mit Silbernitratlösung (3.3) unter Verwendung des Potentiographen (4.2) titriert. 20 ml der Lösung 5.1 werden ebenfalls mit Silbernitratlösung (3.3) titriert. Enthält das Erzeugnis Brom- oder Jod-Derivate, die nach Reduktion Bromide oder Jodide freisetzen, so weist die Titrationskurve mehrere Wendepunkte auf. In diesem Fall ist das Volumen an Silbernitratlösung (3.3), das dem Chlorid entspricht, gleich der Volumendifferenz zwischen dem letzten und vorletzten Wendepunkt.
- 6. BERECHNUNG
Der Chloratgehalt der Probe wird nach der Formel
berechnet.
V | = | Volumen der Silbernitratlösung (3.3) in ml, das zur Titration der Lösung 5.2 verbraucht wurde. |
V' | = | Volumen der Silbernitratlösung (3.3) in ml, das zur Titration der Lösung 5.1 verbraucht wurde |
M | = | Molarität der verwendeten Silbernitratlösung (3.3) |
m | = | Masse der Probe in g |
- 7. WIEDERHOLBARKEIT (1)
Bei einem Chloratgehalt von 3 bis 5 % darf die Differenz zwischen den Ergebnissen zweier parallel an der gleichen Probe durchgeführten Bestimmungen 0,07 Massenprozent nicht überschreiten.
______________
(1) Nach der Norm ISO 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138672
alte Dokumentnummer
N8199547979J
Zusatzdokumente: image001, image002
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)