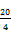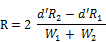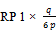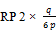Anlage 24
NACHWEIS UND QUANTITATIVE BESTIMMUNG VON GLYCERIN-1-(4-AMINOBENZOAT)
A. IDENTIFIZIERUNG
- 1. ZWECK UND ANWENDUNGSBEREICH
Dieses Verfahren dient zum Nachweis des Glycerin-1-(4-Aminobenzoats) oder Monoglycerinesters der 4-Aminobenzoesäure. Es gestattet ebenfalls den Nachweis des gegebenenfalls als Verunreinigung vorhandenen Ethylesters der 4-Aminobenzoesäure.
- 2. PRINZIP
Die Identifizierung erfolgt durch Dünnschichtchromatographie auf Kieselgelplatten mit Fluoreszenzindikator und Nachweis der primären Aminfunktion durch Bildung eines Diazofarbstoffes auf der Platte.
- 3. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 3.1. Lösungsmittelgemisch: Cyclohexan – Isopropanol – stabilisiertes Dichlormethan: 48 – 64 – 9 (v/v/v)
- 3.2. Fließmittelgemisch: Petrolether (40 – 60 °C) – Benzol – Aceton – Ammoniak (mindestens 25 % NH3): 35 – 35 – 35 – 1 (v/v/v/v)
- 3.3. Sprühmittel:
Lösung a): Natriumnitrit: 1,0 g in 100 ml 1 M HCl (kurz vor Gebrauch zuzubereiten)
Lösung b): 2-Naphthol: 0,2 g in 100 ml 1 M KOH
- 3.4. Standardlösungen: Monoglycerinester der 4-Aminobenzoesäure: 0,05 g in 100 ml Lösungsmittelgemisch (3.1)
Ethylester der 4-Aminobenzoesäure: 0,05 g in 100 ml Lösungsmittelgemisch (3.1)
- 3.5. DC-Fertigplatten Kieselgel 60 F 254, Schichtdicke 0,25 mm. 20 cm x 20 cm oder gleichwertiges
- 4. GERÄTE
- 4.1. Übliches Chromatographiegerät
- 4.2. Ultraschallbad
- 4.3. Millipore-Filter FH, 0,5
m oder gleichwertiges
- 5. ARBEITSWEISE
- 5.1. Probenvorbereitung
1,5 g des zu analysierenden Stoffes in ein verschließbares graduiertes 10-ml-Gefäß einwägen und mit dem Lösungsmittelgemisch (3.1) auf 10 ml auffüllen. Gefäß verschließen und eine Stunde lang bei Zimmertemperatur ins Ultraschallbad stellen. Durch ein Millipore-Filter (4.3) filtrieren. Filtrat für die Chromatographie verwenden.
- 5.2. Dünnschichtchromatographie
10
l des Filtrats (5.1) und je 10
l der Standardlösungen (3.4) auf eine DC-Platte (3.5) auftragen. Chromatogramm in einem zuvor mit dem Fließmittelgemisch (3.2) gesättigten Gefäß 15 cm entwickeln. Die Platte bei Zimmertemperatur unter dem Abzug trocknen lassen.
- 5.3. Nachweis
- 5.3.1. Platte unter UV-Licht (254 nm) betrachten.
- 5.3.2. Die völlig trockene Platte mit Sprühmittel 3.3 Buchstabe a) besprühen. Bei Zimmertemperatur 1 Minute trocknen lassen und sofort danach Sprühmittel 3.3 Buchstabe b) sprühen. Platte im Trockenschrank bei 60 °C trocknen lassen. Die Flecken färben sich orange.
Monoglycerinester der 4-Aminobenzoesäure: Rf ca. 0,07 Ethylester der 4-Aminobenzoesäure: Rf ca. 0,55
B. QUANTITATIVE BESTIMMUNG
- 1. ZWECK UND ANWENDUNGSBEREICH
Dieses Verfahren dient zur Bestimmung des Monoglycerinesters der 4-Aminobenzoesäure. Diese Methode gestattet ebenfalls die Bestimmung des Ethylesters der 4-Aminobenzoesäure.
Sie eignet sich zur Bestimmung von höchstens 5 % (m/m) Monoglycerinester der 4‑Aminobenzoesäure und 1 % (m/m) Ethylester der 4-Aminobenzoesäure.
- 2. DEFINITION
Der nach diesem Verfahren bestimmte Gehalt an Monoglycerinester und Ethylester der 4‑Aminobenzoesäure wird als Massenprozent (% m/m) dargestellt.
- 3. PRINZIP
Nach geeigneter Vorbehandlung des zu analysierenden Produktes wird die Bestimmung mit Hochdruckflüssigkeitschromatographie (HPLC) durchgeführt.
- 4. REAGENZIEN
Alle Reagenzien müssen analysenrein bzw. für HPLC geeignet sein.
- 4.1. Methanol
- 4.2. Kaliumdihydrogenorthophosphat KH2PO4
- 4.3. Zink-di(acetat) Zn (CH3COO)2
H2O
- 4.4. Essigsäure,
- 4.5. Kaliumferrocyanid K4[Fe(CN6]
3H2O
- 4.6. Ethylester der 4-Hydroxybenzoesäure
- 4.7. Monoglycerinester der 4-Aminobenzoesäure
- 4.8. Ethylester der 4-Aminobenzoesäure (Benzocain)
- 4.9. Pufferlösung 0,02 M: 2,72 g Kaliumdihydrogenorthophosphat (4.2) in 1 l destilliertem Wasser lösen
- 4.10. Fließmittel: Pufferlösung (4.9) – Methanol (4.1) 61 – 39 (v/v)
Die Zusammensetzung dieses Fließmittels kann verändert werden, um einen Auflösungsfaktor R ≥ 1,5 zu erhalten.
R1 und R2 | = | Retentionszeiten von 2 Peaks in min |
W1 und W2 | = | Breite derselben Peaks bei halber Höhe in mm |
d' | = | Papiervorschub in mm/min |
- 4.11. Stammlösung für Monoglycerinester der 4-Aminobenzoesäure: ungefähr 40 mg Monoglycerinester der 4-Aminobenzoesäure in einen Meßkolben von 100 ml genau einwiegen und in 40 ml Methanol (4.1) lösen. Mit Pufferlösung (4.9) auffüllen und mischen.
- 4.12. Stammlösung für Ethylester der 4-Aminobenzoesäure: ungefähr 40 mg Ethylester der 4-Aminobenzoesäure in einen Meßkolben von 100 ml genau einwiegen und in 40 ml Methanol (4.1) lösen. Mit Pufferlösung (4.9) auffüllen und mischen.
- 4.13. Interne Standardlösung: 50 mg (q mg) Ethylester der 4-Hydroxybenzoesäure (4.6) auf 0,5 mg genau in einen 100-ml-Meßkolben einwägen und in 40 ml Methanol (4.1) lösen. Mit Pufferlösung (4.9) auffüllen und mischen.
- 4.14. Standardlösungen: Durch Lösen in 100 ml Fließmittel (4.10) vier Standardlösungen gemäß nachstehender Tabelle zubereiten:
Standard- | Monoglycerinester der | Ethylester der | Ethylester der | |||
ml (4.11) | ml (4.12) | ml (4.13) | ||||
I | 2 | 8 | 2 | 8 | 10 | 50 |
II | 4 | 16 | 3 | 12 | 10 | 50 |
III | 6 | 24 | 4 | 16 | 10 | 50 |
IV | 10 | 40 | 5 | 20 | 10 | 50 |
NB.: Diese Lösungen können auf verschiedene Weise erreicht werden. | ||||||
- 4.15. Carrez-I-Lösung: 26,5 g Kaliumferrocyanid (4.5) in Wasser lösen und auf 250 ml auffüllen.
- 4.16. Carrez-II-Lösung: 54,9 g Zink-di(acetat) (4.3) und 7,5 ml Essigsäure (4.4) in Wasser lösen und auf 250 ml auffüllen.
- 4.17. Lichrosorb RP 18, 5
m oder gleichwertiges Erzeugnis.
- 5. GERÄTE
- 5.1. Übliches Laborgerät
- 5.2. Flüssigchromatograph mit UV-Detektor mit variabler Wellenlänge und Säulenthermostat (45 °C)
- 5.3. Edelstahlsäule
Länge: | 25 cm |
Innendurchmesser: | 4,6 mm |
Säulenfüllung: | Lichrosorb RP 18 (4.17) |
- 5.4. Ultraschallbad
- 6. VERFAHREN
- 6.1. Probenvorbereitung
- 6.1.1. Ungefähr 1 g (p g) der Probe in ein Becherglas von 100 ml genau einwiegen und 10 ml Methanol (4.1) hinzufügen.
- 6.1.2. Becherglas 20 Minuten in das Ultraschallbad (5.4) stellen und eine Suspension erzeugen. Diese Suspension mit höchstens 75 ml Fließmittel (4.10) quantitativ in einen Meßkolben von 100 ml umgießen. Nacheinander 1 ml Carrez-I-Lösung (4.15) und 1 ml Carrez-II-Lösung (4.16) hinzufügen und nach jeder Hinzugabe mischen.
Mit Fließmittel (4.10) auffüllen, nochmals mischen und durch ein Faltenfilter filtrieren.
- 6.1.3. Mit einer Pipette 3,0 ml des nach 6.1.2 erhaltenen Filtrats und 5,0 ml interne Standardlösung (4.13) in einen Meßkolben von 50 ml geben. Mit Fließmittel (4.10) auffüllen und mischen. Die so erhaltene Probelösung für die in 6.2 beschriebene chromatographische Analyse benutzen.
- 6.2. Chromatographie
- 6.2.1. Säulendurchfluß des Fließmittelgemischs (4.10) auf 1,2 ml/min einstellen und die Säulentemperatur auf 45 °C bringen.
- 6.2.2. Detektor (5.2) auf 274 nm einstellen.
- 6.2.3. 20
l Probelösung (6.1.3) einspritzen und die Peakflächen messen.
- 6.3. Eichkurven
- 6.3.1. Von jeder der in 4.14 definierten Standardlösungen 20
l nach 6.2.3 einspritzen und Peakflächen messen.
- 6.3.2. Für jede Konzentration ist das Verhältnis zwischen der Peakfläche des Monoglycerinesters der 4Aminobenzoesäure und der Peakfläche des internen Standards zu berechnen. Zeichne die Eichkurve, indem diese Peakflächen-Verhältnisse auf der Ordinate und die entsprechenden Massenverhältnisse auf der Abszisse aufgetragen werden.
- 6.3.3. Entsprechend ist für den Ethylester der 4-Aminobenzoesäure zu verfahren.
- 7. BERECHNUNG
- 7.1. Für die in 6.2.3 erhaltenen Peakflächen-Verhältnisse können auf den nach 6.3 erhaltenen Eichkurven die entsprechenden Massenverhältnisse RP 1 und RP 2 abgelesen werden:
RP 1 = | Massenverhältnis Monoglycerinester der 4-Aminobenzoesäure/Ethylester der 4‑Hydroxybenzoesäure |
RP 2 = | Massenverhältnis Ethylester der 4-Aminobenzoesäure/Ethylester der 4‑Hydroxybenzoesäure |
- 7.2. Anhand dieser Massenverhältnisse berechnet man den Gehalt an Monoglycerinester der 4Aminobenzoesäure und Ethylester der 4-Aminobenzoesäure als Massenprozent (% m/m) nach folgenden Formeln:
% (m/m) Monoglycerinester der 4-Aminobenzoesäure =
% (m/m) Ethylester der 4-Aminobenzoesäure =
q = | nach 4.13 eingewogene Menge Ethylester der 4-Hydroxybenzoesäure (interner Standard) in mg |
p = | nach 6.1.1 eingewogene Probemenge in g |
- 8. WIEDERHOLBARKEIT (1)
- 8.1. Bei einem Gehalt an Monoglycerinester der 4-Aminobenzoesäure von 5 % (m/m) darf der Unterschied zwischen den Ergebnissen von zwei Parallelbestimmungen an der gleichen Probe 0,25 % nicht überschreiten.
- 8.2. Bei einem Gehalt an Ethylester der 4-Aminobenzoesäure von 1 % (m/m) darf der Unterschied zwischen den Ergebnissen von zwei Parallelbestimmungen an der gleichen Probe 0,10 % nicht überschreiten.
- 9. ANMERKUNGEN
- 9.1. Vor der eigentlichen Analyse vergewissere man sich, daß die Probe keine Verbindungen enthält, deren Peak auf dem Chromatogramm mit demjenigen des internen Standards zusammenfällt.
- 9.2. Um sicher zu sein, daß keine weiteren Interferenzen vorhanden sind, ist die Bestimmung zu wiederholen, wobei das Verhältnis des Methanol in der mobilen Phase um
10 % verändert werden kann.
___________
(1) Nach der Norm ISO 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138668
alte Dokumentnummer
N8199547975J
Zusatzdokumente: image001, image002, image003, image004, image005, image006, image007, image008, image009
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)