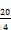Anlage 21
QUANTITATIVE BESTIMMUNG DES GESAMTFLUORIDS IN ZAHNPASTEN
- 1. ANWENDUNGSBEREICH
Dieses Verfahren dient der Bestimmung des Gesamtfluoridgehalts in Zahnpasten. Es eignet sich für Gehalte bis zu 0,25 %.
- 2. DEFINITION
Der nach dieser Methode bestimmte Gehalt der Probe an Fluorid wird in Massenprozent ausgedrückt.
- 3. PRINZIP
Die Bestimmung erfolgt gaschromatographisch. Das Fluorid wird durch direkte Reaktion mit Triethylchlorsilan (TECS) in saurer Lösung zu Triethylfluorsilan (TEFS) umgewandelt und gleichzeitig mit Xylol, das Cyclohexan als inneren Standard enthält, extrahiert.
- 4. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 4.1. Natriumfluorid, bei 120 °C bis zur Gewichtskonstanz getrocknet.
- 4.2. Wasser, doppelt destilliert oder von vergleichbarer Qualität.
- 4.3. Konzentrierte Salzsäure
- 4.4. Cyclohexan (CH).
- 4.5. Xylol, das im Chromatrogramm vor dem Lösungsmittelpeak keine Peaks enthält, wenn man unter den gleichen Bedingungen wie bei der Probe chromatographiert. Falls erforderlich, durch Destillation reinigen (5.8).
- 4.6. Triethylchlorsilan (TECS Merck oder gleichwertiges Erzeugnis).
- 4.7. Fluorid-Standardlösungen
- 4.7.1. Stammlösung:
0,250 mg F-/ml. 138,1 mg Natriumfluorid (4.1) genau einwägen und in Wasser (4.2) lösen. Lösung quantitativ in einen 250-ml-Meßkolben (5.5) geben, bis zur Marke mit Wasser (4.2) auffüllen und mischen.
- 4.7.2 Verdünnte Stammlösung:
0,050 mg F-/ml. Mit der Pipette 20,0 ml Stammlösung (4.7.1) in einen 100-ml-Meßkolben (5.5) geben, bis zur Marke auffüllen und mischen.
- 4.8. Interner Standard
1,0 ml Cyclohexan (4.4) und 5,0 ml Xylol (4.5) mischen.
- 4.9. Triethylchlorsilan/Interne Standard-Lösung
Mit einer Pipette (5.7) 0,6 ml TECS (4.6) und 0,12 ml des Internen Standards (4.8) in einen 10-ml-Meßkolben geben. Mit Xylol (4.5) zur Marke auffüllen und mischen. Täglich frisch zubereiten.
- 4.10. Perchlorsäure 70% (m/v).
- 4.11. Perchlorsäure 20% (m/v) in Wasser (4.2).
- 5. GERÄTE
- 5.1. Übliches Laborgerät.
- 5.2. Gaschromatograph mit Flammenionisationsdetektor.
- 5.3. Vortex-Homogenisator oder gleichwertiges Gerät.
- 5.4. Schüttelmaschine für Reagenzgläser oder gleichwertiges Gerät.
- 5.5. Meßkolben aus Polypropylen, 100 und 250 ml.
- 5.6. Zentrifugengläser aus Glas, 20 ml mit Schraubverschluß und Tefloneinlage oder gleichwertige Gläser und Verschlüsse durch mehrstündiges Auslaugen in Perchlorsäure (4.11) reinigen, anschließend fünfmal mit Wasser (4.2) spülen und bei 100 °C trocknen.
- 5.7. Pipette mit verstellbarem Volumen zwischen 50 und 200
l mit Wegwerfspitzen.
- 5.8. Destillationsapparatur mit Schneider-Destillieraufsatz mit drei Kugeln oder vergleichbarer Vigreux-Kolonne.
- 6. VERFAHREN
- 6.1. Vorbereitung der Probe
- 6.1.1. Eine noch nicht geöffnete Tube Zahnpasta auswählen, aufschneiden und den gesamten Inhalt entnehmen. In einen Kunststoffbehälter geben, eingehend mischen und vor Verderb geschützt aufbewahren.
- 6.1.2. Genau 150 mg der Probe (m) in ein Zentrifugenglas (5.6) einwägen, 5 ml Wasser (4.2) hinzufügen und homogenisieren.
- 6.1.3. 1,0 ml Xylol (4.5) hinzugeben.
- 6.1.4. Tropfenweise 5 ml Salzsäure (4.3) hinzufügen und homogenisieren (5.3).
- 6.1.5. Mit einer Pipette 0,5 ml Triethylchlorsilan/Interne Standardlösung (4.9) in das Zentrifugenglas (5.6) geben.
- 6.1.6. Das Glas mit dem Schraubverschluß (5.6) verschließen und 45 Minuten lang mit 150 Erschütterungen pro Minute gründlich schütteln (5.4).
- 6.1.7. Zehn Minuten mit der Geschwindigkeit zentrifugieren, die erforderlich ist, um eine gute Phasentrennung zu erhalten. Das Glas öffnen, die organische Schicht entnehmen und 3
l der organischen Phase in die Säule des Gaschromatographen (5.2) injizieren.
Anmerkung:
Nach etwa 20 Minuten sind alle Komponenten von der GC-Säule eluiert.
- 6.1.8. Einspritzung wiederholen, das durchschnittliche Verhältnis der Peakfläche ATEFS/ACH berechnen und die entsprechende Menge Fluorid in mg (m1) aus der Eichgeraden (6.3) ablesen.
- 6.1.9. Gesamtfluoridgehalt der Probe in Massenprozent nach 7 berechnen.
- 6.2. Chromatographiebedingungen
6.2.1 | Säule: | Edelstahl. |
Länge: | 180 cm. | |
Durchmesser: | 3 mm. | |
Füllung: | Gaschrom Q 80-100 mesh. | |
Stationäre Phase: | Siliconöl DC 200 (oder vergleichbares): 20%. | |
Die Säule wird jeweils über Nacht mit 25 ml Stickstoff/Minute bei 100 °C konditioniert.
Nach jeder vierten oder fünften Einspritzung muß die Säule 30 Minuten bei 100 °C ausgeheizt werden.
Temperaturen:
Säule: | 70 °C. |
Injektor: | 150 °C. |
Detektor: | 250 °C. |
Trägergas:
35 ml Stickstoff/Minute.
- 6.3. Erstellung der Eichgeraden
- 6.3.1. Mit einer Pipette werden 0, 1, 2, 3, 4 und 5 ml der verdünnten Fluorid-Stammlösung (4.7.2) in sechs verschiedene Zentrifugengläser (5.6) gegeben. Das Volumen wird mit Wasser (4.2) jeweils auf 5,0 ml ergänzt.
- 6.3.2. Es wird unter 6.1.3 bis 6.1.6 verfahren.
- 6.3.3. 3
l der organischen Phase werden in die Säule des Gaschromatographen (5.2) injiziert.
- 6.3.4. Einspritzung wiederholen und das durchschnittliche Verhältnis der Peakflächen ATEFS/ACH berechnen.
- 6.3.5. Es wird eine Eichgerade erstellt aus der jeweiligen Konzentration des Fluorids (mg) der Standardlösung (6.3.1) und den dazugehörigen nach 6.3.4 berechneten Verhälnissen (Anm.: richtig: Verhältnissen) der Peakflächen ATEFS/ACH. Die Punkte auf dem Diagramm werden durch die geeignetste Gerade verbunden, die durch Regressionsanalyse zu ermitteln ist.
- 7. BERECHNUNG
Der in Massenprozent ausgedrückte Gehalt der Probe an Gesamtfluorid wird nach folgender Formel berechnet:
m: Masse der Probe in mg (6.1.2),
m1: aus der Eichgeraden abgelesene Menge Fluorid der Probe in mg (6.1.8).
- 8. WIEDERHOLBARKEIT (1)
Bei einem Fluoridgehalt von 0,15 % (m/m) dürfen die Ergebnisse von zwei mit der gleichen Probe parallel durchgeführten Bestimmungen höchstens um einen absoluten Wert von 0,012% voneinander abweichen.
‑‑‑‑‑‑‑‑‑‑‑‑‑
(1) Siehe ISO-Norm 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138665
alte Dokumentnummer
N8199547972J
Zusatzdokumente: image001, image002, image003, image004
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)