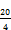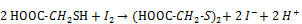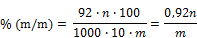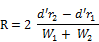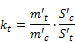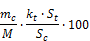Anlage 18
NACHWEIS UND QUANTITATIVE BESTIMMUNG VON THIOGLYKOLSÄURE IN DAUERWELLENPRÄPARATEN, HAARENTKRÄUSELUNGSMITTELN UND ENTHAARUNGSMITTELN
- 1. ANWENDUNGSBEREICH
Die Methode beschreibt den Nachweis und die quantitative Bestimmung von Thioglykolsäure in Dauerwellenpräparaten, Haarentkräuselungsmitteln und Enthaarungsmitteln in Gegenwart anderer, eventuell vorhandener Reduktionsmittel.
- 2. DEFINITION
Der nach dieser Methode bestimmte Gehalt der Probe an Thioglykolsäure wird in Massenprozent Thioglykolsäure angegeben.
- 3. PRINZIP
Thioglykolsäure wird entweder durch Farbreaktionen oder durch Dünnschichtchromatographie nachgewiesen. Ihre quantitative Bestimmung erfolgt entweder durch Jodometrie oder Gaschromatographie.
- 4. NACHWEIS
- 4.1. Nachweis durch Farbreaktion
- 4.1.1. Reagenzien
Alle Reagenzien müssen analysenrein sein.
- 4.1.1.1. Bleidi(acetat)-Papier.
- 4.1.1.2. Salzsäure (1 vol HCl konzentriert + 1 vol H2O).
- 4.1.2. Verfahren
- 4.1.2.1. Nachweis der Thioglykolsäure durch Farbreaktion mit Bleidi(acetat):
Bringe einen Tropfen der zu untersuchenden Probe auf Bleidi(acetat)-Papier (4.1.1.1). Erscheint eine intensive Gelbfärbung, liegt wahrscheinlich Thioglykolsäure vor.
Empfindlichkeit: 0,5%.
- 4.1.2.2. Nachweis anorganischer Sulfide durch Bildung von H2S nach Ansäuern:
Bringe einige mg der zu untersuchenden Probe in ein Reagenzglas. Füge 2 ml Wasser und 1 ml Salzsäure (4.1.1.2) hinzu. Es entwickelt sich H2 S, erkennbar an seinem Geruch und der Bildung eines schwarzen Niederschlags von PbS auf dem Bleiacetat-Papier.
Empfindlichkeit: 50 ppm.
- 4.1.2.3. Nachweis von Sulfiten durch Bildung von SO2 nach Ansäuern:
Verfahre wie in Abschnitt 4.1.2.2. Bringe zum Kochen. SO2 ist erkennbar an seinem Geruch und seinem Reduktionsvermögen z. B. gegenüber MnO4–.
- 4.2. Nachweis durch Dünnschichtchromatographie
- 4.2.1. Reagenzien
Alle Reagenzien müssen, wenn nicht anders angegeben, analysenrein sein.
- 4.2.1.1. Thioglykolsäure mindestens 98 % (Reinheit jodometrisch bestimmt).
- 4.2.1.2. Dithioglykolsäure mindestens 99 %.
- 4.2.1.3. Thiomilchsäure mindestens 95 %.
- 4.2.1.4. 3-Mercaptopropionsäure mindestens 98 %.
- 4.2.1.5. Thioglycerin (3-Mercaptopropan-1,2-diol) mindestens 98 %.
- 4.2.1.6. DC-Fertigplatten Kieselgel, Schichtdicke 0,25 mm.
- 4.2.1.7. DC-Fertigplatten Aluminiumoxid, Schichtdicke 0,25 mm (z. B. Merck F 254 E oder gleichwertige).
- 4.2.1.8. HCl konzentriert
- 4.2.1.9. Ethylacetat.
- 4.2.1.10. Chloroform.
- 4.2.1.11. Diisopropylether.
- 4.2.1.12. Tetrachlorkohlenstoff.
- 4.2.1.13. Eisessig.
- 4.2.1.14. Kaliumjodid 1 % (m/v) in Wasser.
- 4.2.1.15. Platintetrachlorid 0,1 % (m/v) in Wasser.
- 4.2.1.16. Laufmittel:
4.2.1.16.1. Ethylacetat-Chloroform-Diisopropylether-Eisessig (20: 20: 10: 10) (v/v/v/v).
4.2.1.16.2. Chloroform-Eisessig (90 : 20) (v/v).
- 4.2.1.17. Sprühmittel:
4.2.1.17.1. Mische unmittelbar vor Gebrauch gleiche Volumen von Lösung 4.2.1.14 und 4.2.1.15.
4.2.1.17.2. Bromlösung 5 % (m/v). Löse 5 g Brom in 100 ml Tetrachlorkohlenstoff (4.2.1.12).
4.2.1.17.3. Fluoreszeinlösung 0,1 % (m/v). Löse 100 mg Fluoreszein in 100 ml Ethanol 9 5%.
4.2.1.17.4. Hexaammoniumheptamolybdat 10 % (m/v) in Wasser.
- 4.2.1.18. Referenzlösungen:
4.2.1.18.1. Thioglykolsäure 0,4 % (m/v) in Wasser.
4.2.1.18.2. Dithioglykolsäure 0,4 % (m/v) in Wasser.
4.2.1.18.3. Thiomilchsäure 0,4 % (m/v) in Wasser.
4.2.1.18.4. 3-Mercaptopropionsäure 0,4 % (m/v) in Wasser.
4.2.1.18.5. Thioglycerin 0,4 % (m/v) in Wasser.
- 4.2.2. Geräte
Übliche Geräte für die Dünnschichtchromatographie.
- 4.2.3. Verfahren
- 4.2.3.1. Behandlung der Proben
Die Probe mit Salzsäure (4.2.1.8) ansäuern (pH = 1) und, falls erforderlich, filtrieren. In gewissen Fällen ist es ratsam, die Probe zu verdünnen. Dann wird das Ansäuern mit Salzsäure vor der Verdünnung vorgenommen.
- 4.2.3.2. Entwicklung
Bringe 1
l der Probenlösung (4.2.3.1) und je 1
l der fünf Referenzlösungen (4.2.1.18) auf die Platte. Trockne vorsichtig in einem schwachen Stickstoffstrom und entwickle mit dem Fließmittel (4.2.1.16.1) oder (4.2.1.16.2). Trockne so rasch wie möglich unter Stickstoff zur Vermeidung der Oxidation der Thiole.
- 4.2.3.3. Anfärbung
Besprühe die Platte mit einem der drei Reagenzien (4.2.1.17.1), (4.2.1.17.3) oder (4.2.1.17.4). Wurde die Platte mit Reagenz (4.2.1.17.3) besprüht, wird sie weiter mit Bromdampf behandelt: stelle sie in ein mit Brom (4.2.1.17.2) gesättigtes Gefäß, bis die Flecke sichtbar werden.
Die Anfärbung mit dem Sprühmittel (4.2.1.17.4) ist nur dann zufriedenstellend, wenn das Trocknen der Platte ½ Stunde nicht überschreitet.
- 4.2.3.4. Auswertung
Vergleiche die Rf-Werte und die Farbe der Referenzlösungen mit denen der Probenlösung. Die hier angegebenen Rf-Mittelwerte können nur als Anhaltspunkte und nicht zum direkten Vergleich dienen. Sie sind abhängig von
- dem Aktivierungszustand der DC-Platte während des Chromatographierens,
- der Temperatur des Chromatographiegefäßes.
Beispiele für auf einer Kieselgelschicht erhaltene Rf-Werte | ||
Fließmittel | ||
4.2.1.16.1 | 4.2.1.16.2 | |
Thioglykolsäure | 0,25 | 0,80 |
Thiomilchsäure | 0,40 | 0,95 |
Dithioglykolsäure | 0,00 | 0,35 |
3-Mercaptopropionsäure | 0,45 | 0,95 |
Thioglycerin | 0,45 | 0,35 |
- 5. QUANTITATIVE BESTIMMUNG (*)
Die Bestimmung beginnt immer mit der Jodometrie.
- 5.1. Jodometrie
- 5.1.1. Prinzip
Die quantitative Bestimmung erfolgt durch Oxidation der SH-Gruppe durch I2 in saurem Medium nach folgender Gleichung:
- 5.1.2. Reagenzien
Jodlösung 0,1 N.
- 5.1.3. Geräte
Übliche Laborgeräte.
- 5.1.4. Verfahren
Wäge in einen 150 ml-Erlenmeyer-Kolben mit Stopfen, der 50 ml destilliertes Wasser enthält, etwa 0,5 bis 1 g der Probe genau ein. Füge 5 ml der Salzsäure (4.1.1.2) (pH-Wert der Lösung etwa 0) hinzu und titriere mit der 0,1 N-Jodlösung (5.1.2) bis zum Auftreten einer Gelbfärbung. Es kann auch ein Indikator verwendet werden (z. B. Stärkelösung oder Tetrachlorkohlenstoff).
- 5.1.5. Berechnung
Der Gehalt an Thioglykolsäure wird nach folgender Formel berechnet:
m: Masse in g der untersuchten Probe,
n: Volumen der verbrauchten 0,1 N-Jodlösung.
- 5.1.6. Bemerkungen
Liegt das für Thioglykolsäure errechnete Ergebnis um 0,1 % oder mehr unter der zulässigen Höchstmenge, so erübrigt es sich, weitere quantitative Bestimmungen vorzunehmen.
Ist das Ergebnis gleich oder höher als die zulässige Höchstmenge und hat der qualitative Nachweis die Anwesenheit weiterer Reduktionsmittel angezeigt, so muß eine weitere quantitative Bestimmung durch Gaschromatographie durchgeführt werden.
- 5.2. Gaschromatographie
- 5.2.1. Prinzip
Die Thioglykolsäure wird durch Fällen mit Cadmium-di(acetat)-Lösung von der Matrix getrennt.
Nach Methylierung durch Diazomethan – in situ hergestellt oder zuvor in etherischer Lösung bereitet – wird das Methylderivat der Thioglykolsäure quantitativ durch Gas-Flüssig-Chromatographie mit Methylcaprylat als interner Standard bestimmt.
- 5.2.2. Reagenzien
Alle Reagenzien müssen analysenrein sein.
- 5.2.2.1. Thioglykolsäure 98%.
- 5.2.2.2. Salzsäure konzentriert
- 5.2.2.3. Methanol.
- 5.2.2.4. Cadmiumdi(acetat) . 2H2O, 10 % (m/v) in Wasser.
- 5.2.2.5. Methylcaprylatlösung, 2 % (m/v) in Methanol.
- 5.2.2.6. Acetat-Pufferlösung – pH 5:
Natriumacetat, 3 H2O: 77 g,
Eisessig: 27,5 ml,
mit entmineralisiertem Wasser zu 1 l auffüllen.
- 5.2.2.7. Salzsäurelösung, 3 N in Methanol, frisch hergestellt.
- 5.2.2.8. N-Methyl-N-Nitroso-N'-Nitroguanidin.
- 5.2.2.9. Natronlauge 5 N.
- 5.2.2.10. Jodlösung 0,1 N.
- 5.2.2.11. Diethylether.
- 5.2.2.12. Diazomethanlösung, hergestellt aus dem N-Methyl-N-Nitroso-p-Toluolsulfonamid (Fieser, Reagents for Organic Synthesis Ed. Wiley 1967).
Die Lösung enthält etwa 1,5 g Diazomethan in 100 ml Ether (5.2.2.11).
Diazomethan ist ein giftiges und sehr instabiles Gas; es ist deshalb erforderlich, alle Handhabungen unter einem starken Abzug durchzuführen und die Verwendung von Geräten mit Schliffverbindungen zu vermeiden (es gibt spezielle für diesen Zweck bestimmte Geräte).
- 5.2.3. Geräte
- 5.2.3.1. Übliches Laborgerät.
- 5.2.3.2. Gerät zur in situ-Herstellung von Diazomethan (Anal. Chem. 45, 1973, 2302).
- 5.2.3.3. Gerät zur Herstellung von Diazomethan nach Fieser.
- 5.2.4. Probenvorbereitung
Wäge in ein 50 ml Zentrifugenglas die Probe genau ein, die der vermuteten Thioglykolsäuremenge von 50 bis 70 mg entspricht. Mit einigen Tropfen konzentrierter HCL (5.2.2.2) bis zum Erreichen eines pH-Wertes ungefähr 3 ansäuern.
Füge hinzu: 5 ml entmineralisiertes Wasser,
10 ml Acetatpuffer (5.2.2.6).
Mit Indikatorpapier nachprüfen, daß der pH-Wert etwa 5 beträgt.
Dann: 5 ml Cadmiumdi(acetat)lösung (5.2.2.4).
10 Minuten stehen lassen und dann mindestens 15 Minuten lang bei 4 000 g zentrifugieren.
Die obenstehende Flüssigkeit abtrennen. Diese kann (z. B. bei einer Creme) unlösliches Fett enthalten, letzteres darf nicht mit den am Boden des Röhrchens angesammelten Cadmiummercaptid verwechselt werden. Zu dem Obenschwimmenden einige Tropfen Cadmiumdi(acetat)lösung (5.2.2.4) hinzugeben und nachprüfen, daß keine Ausfällung mehr eintritt.
Wenn der vorausgegangene Nachweis ergeben hat, daß außer Thiolen keine anderen Reduktionsmittel vorliegen, so ist im Obenschwimmenden durch Jodometrie nachzuprüfen, daß die hierin vorliegende Thiolmenge 6 bis 8 % der anfänglichen Menge nicht überschreitet.
In das den Niederschlag enthaltende Zentrifugenglas 10 ml Methanol (5.2.2.3) geben, den Niederschlag mit einem Glasstab gut umrühren und erneut mindestens 15 Minuten lang bei 4 000 g zentrifugieren.
Das Obenschwimmende dekantieren und mittels Jodometrie auf die vollständige Entfernung von Thiolen prüfen.
Wasche den Niederschlag ein zweites Mal nach gleichem Verfahren.
Anschließend werden in das Zentrifugenglas gegeben:
- 2 ml der Methylcaprylat-Lösung (5.2.2.5),
- 5 ml der methanolischen Salzsäure (5.2.2.7).
Das Mercaptid vollständig auflösen (dabei kann eine geringe Menge der Ausfällung ungelöst zurückbleiben). Dies ist Lösung S.
In einem aliquoten Teil der Lösung S überprüfe jodometrisch, daß der Thiolgehalt mindestens 90 % des unter 5.1 erhaltenen beträgt.
- 5.2.5. Methylierung
Die Methylierung wird entweder mit in situ hergestelltem (5.2.5.1) oder mit zuvor bereiteter Diazomethanlösung (5.2.5.2) durchgeführt.
- 5.2.5.1 Methylierung – in situ
Gib 50
l der Lösung S in das 1 ml Ether (5.2.2.11) enthaltende Methylierungsgefäß (5.2.3.2) und methyliere nach Methode 5.2.3.2 mit etwa 300 mg N-Methyl-N-Nitroso-N'-Nitroguanidin (5.2.2.8).
Nach 15 Minuten (die Etherlösung muß gelb sein und somit einen Überschuß an Diazomethan anzeigen) überführe die Probenlösung in ein fest verschließbares 2 ml Gefäß. Über Nacht im Kühlschrank aufbewahren. Methyliere zwei Proben gleichzeitig.
- 5.2.5.2. Methylierung mit zuvor hergestellter Diazomethanlösung
Gib in einen mit Stopfen versehenen 5 ml Kolben 1 ml Diazomethanlösung (5.2.2.12) und dann 50
l der Lösung S.
Über Nacht im Kühlschrank stehen lassen.
- 5.2.6. Herstellung des Standards
Stelle eine Standardlösung von Thioglykolsäure bekannten Gehalts her, die etwa 60 mg reine Thioglykolsäure in 2 ml enthält. Dies ist Lösung E.
Fälle, prüfe und methyliere, wie unter 5.2.4 und 5.2.5 beschrieben.
- 5.2.7 Gaschromatographische Bedingungen
- 5.2.7.1. Säule: rostfreier Stahl
Länge: 2 m
Durchmesser: 3 mm
- 5.2.7.2. Säulenfüllung: 20 % Didecylphthalat/Chromosorb WAW 80-100 mesh.
- 5.2.7.3. Detektor: FID.
Eine geeignete Empfindlichkeitseinstellung des Elektrometers des FID ist 8 x 10–10 A.
- 5.2.7.4. Gase:
Trägergas: | Stickstoff 2,2 bar, |
Durchfluß 35 ml/min. | |
Detektor: | die zu verwendenden Gase entsprechend den Angaben des Herstellers |
- 5.2.7.5. Temperaturen:
Injektor: | 200 °C, |
Detektor: | 200 °C, |
Säule: | 90 °C. |
- 5.2.7.6. Schreibervorschub: 5 mm/min
- 5.2.7.7. Einspritzmenge: 3
l; fünf Einspritzungen je Probe
- 5.2.7.8. Die Chromatographiebedingungen sind Richtwerte. Mit ihnen ist eine Auflösung R gleich oder besser als 1,5 zu erreichen.
r1 und r2 | : | Retentionszeiten in Minuten, |
W1 und W2 | : | Peakbreite bei halber Höhe in mm, |
d' | : | Schreibervorschub in mm/min. |
- 5.2.8. Berechnung
- 5.2.8.1. Responsefaktor der Thioglykolsäure
Es bedeuten:
t: Thioglykolsäure
kt: ihr Proportionalitätsfaktor,
m't: ihre Masse in mg in der Mischung,
S't: ihre Peakfläche;
c: Methylcaprylat
m'c: seine Masse in mg in der Mischung,
S'c: seine Peakfläche
Dieser Responsefaktor ist abhängig von der verwendeten Apparatur.
- 5.2.8.2. Gehalt an Thioglykolsäure in der Probe
Es bedeuten:
t: Thioglykolsäure
kt: ihr Proportionalitätsfaktor,
St: ihre Peakfläche;
c: Methylcaprylat
mc: seine Masse (in mg) in der Mischung,
Sc: seine Peakfläche;
M: die Masse (in mg) der Probe.
% (m/m) Thioglykolsäure in der Probe:
- 6. WIEDERHOLBARKEIT (1)
Bei einem Thioglykolsäuregehalt von 8 % (m/m) darf die Differenz zwischen zwei an der gleichen Probe durchgeführten Parallelbestimmungen 0,8 % (m/m) nicht überschreiten.
____________
(*) Bemerkung: Die Bestimmung der Thioglykolsäure muß an einem noch nicht verwendeten Produkt aus einem frisch geöffneten Behälter zur Vermeidung von Oxidation durchgeführt werden.
(1) Siehe ISO-Norm 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138662
alte Dokumentnummer
N8199547969J
Zusatzdokumente: image001, image002, image003, image004, image005, image006, image007
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)