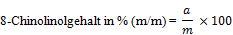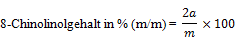Anlage 15
NACHWEIS UND QUANTITATIVE BESTIMMUNG VON 8-CHINOLINOL UND DESSEN SULFAT
- 1. ANWENDUNGSBEREICH
Diese Methode beschreibt die Identifikation und quantitative Bestimmung von 8-Chinolinol und seinem Sulfat in kosmetischen Erzeugnissen.
- 2. DEFINITION
Der nach dieser Methode bestimmte Gehalt der Probe an 8-Chinolinol wird ausgedrückt in Massen-% 8-Chinolinol.
- 3. PRINZIP
- 3.1. Identifikation
Die Identifikation erfolgt durch Dünnschichtchromatographie.
- 3.2. Quantitative Bestimmung
Die quantitative Bestimmung erfolgt durch Photometrie des nach Zugabe von Fehlingscher Lösung gebildeten Kupferkomplexes bei 410 nm.
- 4. REAGENZIEN
Es sind analysenreine Reagenzien zu verwenden.
- 4.1. 8-Chinolinol (8-Hydroxychinolin).
- 4.2. Benzol; wegen seiner Toxizität ist beim Arbeiten mit Benzol größte Vorsicht geboten.
- 4.3. Chloroform.
- 4.4. 50%ige Natriumhydroxidlösung (m/m).
- 4.5. Kupfersulfat . 5 H2O.
- 4.6. Kaliumnatriumtartrat.
- 4.7. Salzsäure 1 N.
- 4.8. Schwefelsäure 1 N.
- 4.9. Natriumhydroxidlösung 1 N.
- 4.10. Ethanol.
- 4.11. n-Butanol.
- 4.12. Eisessig.
- 4.13. Salzsäure 0,1 N.
- 4.14. Celite 545 oder gleichwertiges Produkt.
- 4.15. Vergleichslösungen
- 4.15.1. 100,0 mg 8-Chinolinol (4.1) in einen 100 ml Meßkolben einbringen, in wenig 1 N Schwefelsäure (4.8) lösen und danach mit 1 N H2SO4 (4.8) bis zur Marke auffüllen.
- 4.15.2. 100,0 mg 8-Chinolinol (4.1) in einen 100 ml Meßkolben einbringen, in Ethanol (4.10) lösen, mit Ethanol (4.10) bis zur Marke auffüllen und mischen.
- 4.16. Fehling'sche Lösung
Lösung A
In einen 100 ml Meßkolben 7,0 g Kupfersulfat . 5 H2O (4.5) einwägen. In wenig Wasser auflösen, mit Wasser bis zur Marke auffüllen und mischen.
Lösung B
In einen 100 ml Meßkolben 35,0 g Kaliumnatrium-tartrat (4.6) einwägen und in 50 ml Wasser lösen. Nach dem Zusatz von 20 ml 50%iger Natriumhydroxidlösung (4.4) mit Wasser bis zur Marke auffüllen und mischen.
Unmittelbar vor dem Gebrauch 10,0 ml Lösung A und 10,0 ml Lösung B in einen 100 ml Meßkolben pipettieren und mit Wasser bis zur Marke auffüllen.
- 4.17. Fließmittel für die Dünnschichtchromatographie
I. n-Butanol-Eisessig-Wasser (80-20-20; v/v/v).
II. Chloroform-Eisessig (95-5; v/v).
- 4.18. 1%ige (m/v) Lösung von 2,6-Dichlor-4-(chlorimino)cyclohexa-2,5-dienon in Ethanol (4.10).
- 4.19. 1%ige (m/v) Natriumkarbonatlösung.
- 4.20. 30%ige (v/v) Lösung von Ethanol (4.10) in Wasser.
- 4.21. 5%ige (m/v) Lösung von Dinatriumdihydrogenethylendiamintetraacetat.
- 4.22. Puffer PH 7
27 g KH2PO4 und 70 g K2HPO4
3 H2O in einen 1-Liter-Meßkolben einwägen und mit Wasser auffüllen.
- 4.23. Kieselgeldünnschicht-Fertigplatten
Schichtdicke 0,25 mm (z. B. Kieselgel 60 von Merck oder gleichwertig), die vor dem Gebrauch mit jeweils 10 ml des Reagenz (4.21) besprüht und bei 80 °C getrocknet worden sind.
- 5. GERÄTE
- 5.1. 100 ml Rundkolben mit Schliff.
- 5.2. Meßkolben.
- 5.3. 10 und 5 ml Meßpipetten.
- 5.4. 20, 15, 10, 5 ml Vollpipetten.
- 5.5. 100, 50 und 25 ml Scheidetrichter.
- 5.6. Faltenfilter
9 cm.
- 5.7. Rotationsverdampfer.
- 5.8. Rückflußkühler mit Schliff.
- 5.9. Spektralphotometer.
- 5.10. 1 cm Küvetten.
- 5.11. Rührwerk mit elektrischer Heizung.
- 5.12. Glassäule für Chromatographie, 160 mm Länge und 8 mm Durchmesser, die am unteren Ende eine Verjüngung enthält, in der sich ein Glaswollpfropfen befindet und deren oberes Teil so beschaffen ist, daß unter Anwendung eines geringen Überdruckes eluiert werden kann.
- 6. VERFAHREN
- 6.1. Identifikation
- 6.1.1. Flüssige Proben
- 6.1.1.1. Der PH-Wert eines Teiles der zu untersuchenden Probe wird eingestellt auf 7,0 und sodann werden auf je einen Punkt der Startlinie einer vorbehandelten Kieselgeldünnschichtplatte (4.23) 5 bzw. 10
l aufgetragen.
- 6.1.1.2. Auf zwei weitere Punkte der Startlinie werden 10 bzw. 30
l der Vergleichslösung (4.15.2) aufgetragen. Anschließend wird die Platte in einem der beiden Fließmittel (4.17) entwickelt.
- 6.1.1.3. Nachdem die Fließmittelfront 15 cm erreicht hat, wird die Platte bei 110 °C getrocknet (15 Minuten). Unter der UV-Lampe (366 nm) fluoreszieren die 8-Chinolinolflecke gelb.
- 6.1.1.4. Anschließend wird mit der 1%igen Natriumkarbonatlösung (4.19) besprüht und nach dem Trocknen mit der 1%igen 2,6-Dichlor-4-(chlorimino)cyclohexa-2,5-dienonlösung (4.18). Das 8Chinolinol wird als blauer Fleck sichtbar.
- 6.1.2. Feste Proben bzw. Cremes
- 6.1.2.1. 1 g der Probe wird suspendiert in 5 ml Puffer PH 7 (4.22) und sodann mit 10 ml Chloroform (4.3) in einen Scheidetrichter überführt und ausgeschüttelt. Nach Ablassen der Chloroformschicht wird die wässerige Suspension noch zweimal mit je 10 ml Chloroform (4.3) extrahiert und die vereinigten und filtrierten Chloroformextrakte in einem 100 ml Rundkolben (5.1) am Rotationsverdampfer bis fast zur Trockne eingeengt. Der Rückstand wird in 2 ml Chloroform (4.3) aufgenommen und 10 bzw. 30
l der erhaltenen Lösung werden auf der unter 6.1.1.1 angegebenen Weise auf einer Kieselgeldünnschichtplatte (4.23) aufgetragen.
- 6.1.2.2. Nach dem Auftragen von 10 bzw. 30
l der Vergleichslösung (4.15.2) wird die Platte weiter behandelt wie unter 6.1.1.2 bis einschließlich 6.1.1.4 angegeben.
- 6.2. Quantitative Bestimmung
- 6.2.1. Flüssige Proben
- 6.2.1.1. In einen 100 ml Rundkolben mit Schliff werden 5,00 g der Probe eingewogen, 1 ml der 1 N Schwefelsäure (4.8) zupipettiert und die Mischung bei vermindertem Druck (50 °C) bis fast zur Trockne eingeengt.
- 6.2.1.2. Dieser Rückstand wird in 20 ml warmem Wasser gelöst, in einen 100 ml Meßkolben unter dreimaligem Nachspülen mit je 20 ml Wasser überführt, mit Wasser auf 100 ml aufgefüllt und gemischt.
- 6.2.1.3. Von dieser Lösung werden 5,0 ml in einen 50 ml Scheidetrichter (5.5) einpipettiert. Nach dem Zusatz von 10 ml Fehling'scher Lösung (4.16) wird der entstandene 8-Chinolinol-Kupferkomplex dreimal mit je 8 ml Chloroform (4.3) ausgeschüttelt.
- 6.2.1.4. Die Chloroformphasen werden filtriert und in einem 25 ml Meßkolben (5.2) gesammelt. Nach dem Auffüllen mit Chloroform (4.3) und Umschütteln wird die Extinktion der gelben Lösung bei
= 410 nm gegen Chloroform gemessen.
- 6.2.2. Feste Proben bzw. Cremes
- 6.2.2.1. 0,500 g der Probe werden in einen 100 ml Rundkolben (5.1) eingewogen, 30 ml Benzol (4.2) sowie 20 ml 1 N Salzsäure (4.7) zugefügt und der Kolbeninhalt 30 Minuten am Rückfluß unter Rühren gekocht.
- 6.2.2.2. Der Kolbeninhalt wird in einen 100 ml Scheidetrichter (5.5) überführt und mit 5 ml 1 N HCl (4.7) nachgespült. Die wässerige Phase wird in einen Rundkolben (5.1) überführt, die Benzolphase mit 5 ml 1 N Salzsäure (4.7) nachgewaschen und das Waschwasser mit der übrigen wässerigen Phase vereint. Weiterführung der Analyse wie unter 6.2.2.4 angegeben.
- 6.2.2.3. Im Falle von Emulsionen, die die weitere Aufarbeitung behindern:
0,500 g der Probe werden mit 2 g Celite 545 (4.14) der Art vermischt, daß ein lockeres Puder entsteht. Die Mischung wird portionsweise in eine Chromatographie-Glassäule (5.12) überführt und nach jeder Zugabe die Säulenfüllung fest gepackt mit Hilfe eines Glasstabes. Sobald die gesamte Mischung in die Säule überführt ist, wird mit 0,1 N Salzsäure (4.13) eluiert und zwar so, daß innerhalb von ungefähr zehn Minuten 10 ml Eluat erhalten werden, nötigenfalls kann diese Elution unter einem geringen Stickstoff-Überdruck durchgeführt werden. Während der Elution muß darauf geachtet werden, daß sich immer Salzsäure oberhalb der Säulenfüllung befindet. Die ersten 10 ml Eluat werden wie unter 6.2.2.4 angegeben weiter verarbeitet.
- 6.2.2.4. Die gesammelten wässerigen Phasen (6.2.2.2 bzw. das Eluat 6.2.2.3) werden am Rotationsverdampfer unter vermindertem Druck bis fast zur Trockne eingeengt.
- 6.2.2.5. Der Rückstand wird in 6 ml 1 N Natriumhydroxydlösung (4.9) gelöst, 20 ml Fehling'sche Lösung (4.16) zugefügt und der Kolbeninhalt in einen 50 ml Scheidetrichter (5.5) überführt unter Nachspülen mit 8 ml Chloroform (4.3). Nach dem Ausschütteln wird die Chloroformphase filtriert und in einem 50 ml Meßkolben (5.2) gesammelt.
- 6.2.2.6. Diese Extraktion noch dreimal mit 8 ml Chloroform (4.3) wiederholen. Die Chloroformphasen werden filtriert und ebenfalls in dem 50 ml Meßkolben (5.2) gesammelt.
Nach dem Auffüllen mit Chloroform und Umschütteln wird die Extinktion der gelben Lösung bei
= 410 nm gegen Chloroform gemessen.
- 7. AUFSTELLEN DER EICHKURVE
In je einen 100 ml Rundkolben (5.1), der 3 ml 30%igen wässerigen Ethanol (4.20) enthält, werden 5, 10, 15 bzw. 20 ml der Vergleichslösung (4.15.1) einpipettiert und wie unter 6.2.1 beschrieben aufgearbeitet.
- 8. BERECHNUNG
- 8.1. Flüssige Proben
worin:
a: mg 8-Chinolinol, abgelesen auf der Eichkurve (7),
m (mg): Einwaage der Probe (6.2.1.1).
- 8.2. Feste Proben bzw. Cremes
worin:
a: mg 8-Chinolinol, abgelesen auf der Eichkurve (7),
m (mg): Einwaage der Probe (6.2.2.1).
- 9. WIEDERHOLBARKEIT (1)
Bei einem Gehalt von ca. 0,3% 8-Chinolinol darf der Unterschied zwischen den Ergebnissen zweier Parallelbestimmungen an derselben Probe nicht höher sein als 0,02%.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
(1) Siehe ISO-Norm 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138659
alte Dokumentnummer
N8199547966J
Zusatzdokumente: image001, image002, image003, image004, image005, image006
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)