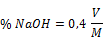Anlage 3
III. NACHWEIS UND QUANTITATIVE BESTIMMUNG DES FREIEN NATRIUM- UND KALIUMHYDROXIDS
- 1. ZWECK UND ANWENDUNGSBEREICH
Die Methode beschreibt die Identifizierung signifikanter Mengen freier Natrium- und/ oder Kaliumhydroxide in kosmetischen Mitteln und die quantitative Bestimmung des freien Natrium- und Kaliumhydroxids in Entkräuselungsmitteln und Nagelhautentfernern.
- 2. DEFINITION
Freies Natrium- und Kaliumhydroxid wird durch die bei der Neutralisation des kosmetischen Mittels unter den vorgeschriebenen Bedingungen verbrauchte (eingestellte) Säuremenge bestimmt. Die titrierte Menge wird als freies Natriumhydroxid angegeben.
- 3. PRINZIP
Die Probe wird in Wasser gelöst oder dispergiert und mit einer eingestellten Säure titriert. Die pH-Wertänderung wird im Verlauf der Säurezugabe registriert. Bei einer einfachen Natrium- oder Kaliumhydroxidlösung entspricht der Endpunkt einer eindeutigen maximalen neutralisierten Mengedes registrierten pH-Wertes.
Die normale Titrationskurve kann verändert werden durch die Anwesenheit von
- a) Ammoniak und andere schwache organische Basen, die selbst eine verhältnismäßig flache Titrationskurve aufweisen. Ammoniak wird bei dieser Methode durch Verdampfen bei vermindertem Druck bei Zimmertemperatur entfernt;
- b) Salzen schwacher Säuren, die eine Titrationskurve mit mehren Umschlagspunkten ergeben können. In solchen Fällen entspricht nur der erste Teil der Kurve bis zu dem ersten Umschlagspunkt der Neutralisation des Hydroxid-Ions durch das freie Natrium- oder Kaliumhydroxid.
Ein Alternativverfahren – die Titration in alkoholischer Lösung – ist dort anzuwenden, wo eine größere Störung durch Salze schwacher Säuren verursacht wird.
Auch wenn theoretisch die Möglichkeit besteht, daß andere lösliche starke Basen, wie zum Beispiel Lithiumhydroxid und quaternäre Ammoniumhydroxide einen hohen pH-Wert verursachen könnten, ist ihre Anwesenheit in kosmetischen Mitteln dieser Art sehr unwahrscheinlich.
- 4. IDENTIFIZIERUNG
- 4.1. Reagenzien
- 4.1.1. standardisierte alkalische Pufferlösung mit einem pH von 9,18:0,05 M Natriumtetraborat-Dekahydrat.
- 4.2. Apparative Ausrüstung
- 4.2.1. übliche Laborgläser
- 4.2.2. pH-Meter
- 4.2.3. Glaselektrode
- 4.2.4. standardisierte Kalomelelektrode.
- 4.3. Verfahren
Die Eichung des pH-Meters erfolgt mit Hilfe der Pufferlösung (4.1.1).
Eine 10%ige Lösung oder Dispersion der Probe ist in Wasser anzusetzen und abzufiltern; der pH-Wert ist zu messen. Bei einem pH-Wert von ≥ 12 ist eine quantitative Bestimmung vorzunehmen.
- 5. QUANTITATIVE BESTIMMUNG
- 5.1. Titration in wäßriger Lösung
- 5.1.1. Reagenzien
- 5.1.1.1. 0,1 N HCl.
- 5.1.2. Apparative Ausrüstung
- 5.1.2.1. übliche Laborgläser
- 5.1.2.2. pH-Meter, eventuell mit Schreiber
- 5.1.2.3. Glaselektrode
- 5.1.2.4. standardisierte Kalomelelektrode.
- 5.1.3. Verfahren
In ein 150-ml-Becherglas werden etwa 0,5 bis 1,0 g der Probe genau eingewogen. Nach Zugabe einiger Siedesteinchen wird das Becherglas, sofern Ammoniak vorhanden ist – in einen Vakuumexsikkator gestellt und mit einer Wasserstrahlpumpe drei Stunden lang evakuiert, bis kein Ammoniakgeruch mehr wahrnehmbar ist. Danach werden 100 ml Wasser hinzugefügt, der Rückstand homogenisiert und mit 0,1 N Salzsäure (5.1.1.1) titriert. Die Änderung des pH-Wertes ist zu registrieren (5.1.2.2).
- 5.1.4. Berechnung
Die Titrationskurve wird aufgenommen und die Umschlagspunkte abgelesen. Tritt der erste Umschlagspunkt bei einem pH-Wert unter 7 auf, so ist die Probe frei von Natrium- oder Kaliumhydroxid. Bei zwei oder mehr Umschlagspunkten sind nur die ersten relevant.
Das Titransvolumen bis zu dem ersten Umschlagspunkt ist festzustellen.
Wenn V das Titransvolumen in ml,
M die Masse dieses Probenteils in Gramm bedeuten, dann ist die Konzentration von Natrium- und/oder Kaliumhydroxiden in der Probe, ausgedrückt in Masseprozent von Natriumhydroxid:
Es ist denkbar, daß sich in der Titrationskurve trotz der Anzeichen für die Anwesenheit einer signifikanten Natrium- oder Kaliumhydroxidmenge kein ausgeprägter Umschlagspunkt ausbildet. In diesem Fall ist die Bestimmung durch Titration in Isopropanol zu wiederholen.
- 5.2. Titration in Isopropanol
- 5.2.1. Reagenzien
- 5.2.1.1. Isopropanol
- 5.2.1.2. 1 N HCl
- 5.2.1.3. 0,1 N HCl in Isopropanol: Unmittelbar vor dem Gebrauch durch Verdünnung der wässerigen 1,0 N HCl mit Isopropanol anzusetzen.
- 5.2.2. Apparative Ausrüstung
- 5.2.2.1. übliche Laborgläser
- 5.2.2.2. pH-Meter, eventuell mit Schreiber
- 5.2.2.3. Glaselektrode
- 5.2.2.4. standardisierte Kalomelelektrode.
- 5.2.3. Verfahren
In einem 150-ml-Becherglas werden etwa 0,5 bis 1,0 g der Probe genau eingewogen. Nach Zugabe einiger Siedesteinchen wird das Becherglas – sofern Ammoniak vorhanden ist – in einen Vakuumexsikkator gestellt und mit einer Wasserstrahlpumpe drei Stunden lang evakuiert, bis kein Ammoniakgeruch mehr wahrnehmbar ist. Danach werden 100 ml Isopropanol hinzugefügt, der Rückstand homogenisiert und mit 0,1 N HCl in Isopropanol (5.2.1.3) titriert. Die Änderung des pH-Wertes (5.2.2.2) ist zu registrieren.
- 5.2.4. Berechnung
Wie in (5.1.4) tritt der erste Umschlagspunkt bei einem pH-Wert von etwa 9 auf.
- 5.3. Wiederholbarkeit (1)
Bei einem Gehalt von 5% m/m darf der Unterschied zwischen den Ergebnissen zweier Parallelbestimmungen an derselben Probe nicht höher sein als 0,25%.
______________
(1) Siehe Norm ISO/DIS 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138647
alte Dokumentnummer
N8199547954J
Zusatzdokumente: image001
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)