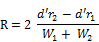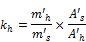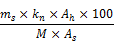Anlage 19
NACHWEIS UND QUANTITATIVE BESTIMMUNG VON HEXACHLOROPHEN
A. IDENTIFIZIERUNG
- 1. ZWECK UND ANWENDUNGSBEREICH
Dieses Verfahren ist für alle kosmetischen Mittel anwendbar.
- 2. PRINZIP
Hexachlorophen in der Probe wird mit Ethylacetat extrahiert und durch Dünnschichtchromatographie nachgewiesen.
- 3. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 3.1. Schwefelsäure 4 M.
- 3.2. Celite AW.
- 3.3. Ethylacetat.
- 3.4. Fließmittel:
Benzol mit 1 % v/v Eisessig.
- 3.5. Sprühmittel 1:
Rhodamin-B-Lösung: 100 mg Rhodamin B werden in einer Mischung von 150 ml Diethylether, 70 ml absolutem Ethanol und 16 ml Wasser gelöst.
- 3.6. Sprühmittel 2:
2,6-Dibrom-4-(chlorimino)cyclohexa-2,5-dienonlösung: 400 mg 2,6-Dibrom-4(chlorimino)cyclohexa-2,5-dienon in 100 ml Methanol lösen (täglich neu zubereiten) Natriumkarbonatlösung: 10 g Natriumkarbonat in 100 ml entmineralisiertem Wasser lösen.
- 3.7. Referenzlösung:
0,05 % m/v Lösung von Hexachlorophen in Ethylacetat (3.3).
- 4. GERÄTE
- 4.1. DC-Fertigplatten Kieselgel F254, 20 x 20 cm.
- 4.2. Übliches Gerät für Dünnschichtchromatographie.
- 4.3. Auf 26 °C temperierbares Bad.
- 5. VORBEREITUNG DER PROBE
- 5.1. 1 g der homogenisierten Probe mit 1 g Celite AW (3.2) und 1 ml Schwefelsäure (3.1) gründlich mischen.
- 5.2. Zwei Stunden lang bei 100 °C trocknen lassen.
- 5.3. Abkühlen lassen und getrockneten Rückstand fein pulverisieren.
- 5.4. Zweimal mit jeweils 10 ml Ethylacetat (3.3) extrahieren, nach jeder Extraktion zentrifugieren und die Ethylacetatschichten vereinigen.
- 5.5. Bei 60 °C eindampfen lassen.
- 5.6. Den Rückstand in 2 ml Ethylacetat lösen.
- 6. VERFAHREN
- 6.1. 2
l der Probelösung (5.6) und 2
l der Referenzlösung (3.7) auf eine DC-Platte (4.1) auftragen.
- 6.2. Das auf 26 °C temperierte Chromatographiegefäß mit dem Fließmittel (3.4) sättigen.
- 6.3. Die DC-Platte in das Gefäß stellen und bis zu einer Höhe von 15 cm entwickeln lassen.
- 6.4. Die DC-Platte entnehmen und im Trockenschrank bei 105 °C trocknen lassen.
- 6.5. Entwicklung:
Hexachlorophenflecken nach 6.5.1 oder 6.5.2 sichtbar machen.
- 6.5.1. Sprühmittel 1 (3.5) gleichmäßig auf die Platte sprühen. Nach 30 Minuten Platte unter UV-Licht (254 nm) betrachten.
- 6.5.2. Sprühmittel 2 (3.6):
Die Platte gleichmäßig mit der 2,6-Dibrom-4-(chlorimino)cyclohexa-2,5-dienonlösung des Sprühmittels 2 (3.6) besprühen. Anschließend mit Natriumkarbonatlösung (3.6) sprühen. Platte nach 10minütiger Trocknung bei Raumtemperatur im Tageslicht betrachten.
- 7. AUSWERTUNG DER ERGEBNISSE
- 7.1. Sprühmittel 1 (3.5):
Hexachlorophen erscheint als bläulicher Fleck auf einem gelb-orange fluoreszierenden Hintergrund, es hat einen Rf-Wert von etwa 0,5.
- 7.2. Sprühmittel 2 (3.6):
Hexachlorophen erscheint als türkisfarbener Fleck auf weißem Grund mit einem Rf-Wert von etwa 0,5.
B. QUANTITATIVE BESTIMMUNG
- 1. ZWECK UND ANWENDUNGSBEREICH
Dieses Verfahren ist für alle kosmetischen Mittel anwendbar.
- 2. DEFINITION
Der nach dieser Methode bestimmte Gehalt der Probe an Hexachlorophen wird in Massenprozent (m/m) ausgedrückt.
- 3. PRINZIP
Hexachlorophen wird nach Umwandlung in das Methylderivat gaschromatographisch mit einem Elektroneneinfangdetektor bestimmt. Bei diesem Verfahren wird ein interner Standard verwendet.
- 4. REAGENZIEN
Alle Reagenzien müssen analysenrein sein.
- 4.1. Ethylacetat.
- 4.2. N-Methyl-N-nitroso-p-toluolsulfonamid (Diazald).
- 4.3. Diethylether.
- 4.4. Methanol.
- 4.5. 2-(2-Ethoxyethoxy)ethanol (Carbitol).
- 4.6. Ameisensäure.
- 4.7. Kaliumhydroxid – wässerige Lösung 50% m/m, unmittelbar vor Gebrauch zubereiten.
- 4.8. Hexan zur Spektroskopie.
- 4.9. Bromchlorophen (Standard Nr. 1).
- 4.10. 4,4',6,6'-Tetrachlor-2,2'-thiodiphenol (Standard Nr. 2).
- 4.11. 2,4,4'-Trichlor-2-hydroxy-diphenylether (Standard Nr. 3).
- 4.12. Aceton.
- 4.13. Schwefelsäure 4M.
- 4.14. Celite AW.
- 4.15. Ameisensäure-Ethylacetatlösung 10 % v/v.
- 4.16. Hexachlorophen.
- 5. GERÄTE
- 5.1. Übliche Laborgeräte.
- 5.2. Apparatur für die Herstellung von Diazomethan – Millimole Size – (vgl. Anal. Chem. 45, 2302 – 3, 1973).
- 5.3. Gaschromatograph mit 63Ni-Elektroneneinfangdetektor.
- 6. VERFAHREN
- 6.1. Zubereitung von Standardlösungen
Der Standard ist so zu wählen, daß es durch keinen in dem zu analysierenden Produkt enthaltenen Stoff gestört wird. Standard Nr. 1 ist normalerweise am besten geeignet.
- 6.1.1. Etwa 50 mg des Standards Nr. 1 (4.9), 2 (4.10) oder 3 (4.11.) und 50 mg Hexachlorophen (4.16) genau wägen und in einen 100-ml-Meßkolben geben. Mit Ethylacetat auffüllen (Lösung A). 10 ml der Lösung A mit Ethylacetat auf 100 ml verdünnen (Lösung B).
- 6.1.2. Etwa 50 mg des Standards Nr. 1 (4.9), 2 (4.10) oder 3 (4.11) genau wägen und in einen 100-ml-Meßkolben geben. Mit Ethylacetat auffüllen (Lösung C).
- 6.2. Zubereitung der Probe (1)
1 g der homogenisierten Probe wird genau gewogen und gründlich mit 1 ml Schwefelsäure (4.13), 15 ml Aceton (4.12) und 8 g Celite AW (4.14) gemischt. Die Mischung wird 30 Minuten lang auf dem Dampfbad luftgetrocknet, anschließend 1 ½ Stunden in einem Umluft-Trockenschrank getrocknet. Abkühlen, den Rückstand zu Pulver fein zerreiben und in eine Glassäule überführen. Mit Ethylacetat eluieren und 100 ml auffangen. 2 ml der internen Standardlösung (6.1.2) hinzufügen.
- 6.3. Methylierung der Probe
Alle Reagenzien und Geräte zwei Stunden lang auf eine Temperatur zwischen 0 °C und 4 °C kühlen. In den Außenteil der Diazomethanapparatur (5.2) 1,2 ml der nach 6.2 erhaltenen Lösung und 0,1 ml Methanol (4.4) füllen.
Etwa 200 mg Diazald (4.2) in den mittleren Behälter füllen, 1 ml Carbitol (4.5) und 1 ml Diethylether (4.3) hinzufügen und lösen. Die Apparatur zusammensetzen, halb in ein Bad von 0 °C tauchen und mit einer Spritze etwa 1 ml der gekühlten Kaliumhydroxidlösung (4.7) in den zentralen Behälter einführen.
Durch Bildung von Diazomethan färbt sich die Lösung gelb; die Gelbfärbung muß beständig sein. Hält sich die gelbe Farbe nicht, so wird der Methylierungsvorgang mit weiteren 200 mg Diazald (4.2) wiederholt (2).
Nach 15 Minuten die Apparatur aus dem Bad nehmen und bei Raumtemperatur zwölf Stunden lang geschlossen stehen lassen. Dann die Apparatur öffnen, das überschüssige Diazomethan durch Hinzufügen weniger Tropfen einer 10 % v/v Lösung von Ameisensäure in Ethylacetat (4.15) entfernen und die organische Lösung in einen 25-ml-Meßkolben bringen. Mit Hexan (4.8) auffüllen.
- 6.4. Methylierung der Standardlösung
Alle Reagenzien und Geräte werden zwei Stunden lang auf 0 °C bis 4 °C gekühlt. In den äußeren Teil der Diazomethanapparatur werden eingefüllt:
0,2 ml Lösung B (6.1.1),
1,0 ml Ethylacetat (4.1),
0,1 ml Methanol (4.4).
Den Methylierungsvorgang wie in 6.3 beschrieben fortsetzen. 1,5
l der resultierenden Lösung in den Chromatographen einspritzen.
- 7. GASCHROMATOGRAPHIEBEDINGUNGEN
Die stationäre Phase muß ein Auflösungsvermögen R vonmindestens 1,5 ergeben.
wobei:
r1 und r2: | Retentionszeiten in Minuten, |
W1 und W2: | Peakbreite bei halber Höhe in mm, |
d': | Schreibervorschub in mm/min. |
Unter den folgenden Verfahrensbedingungen kann dieses Ergebnis erzielt werden:
Säule: | rostfreier Stahl. |
Länge: | 170 cm. |
Durchmesser: | 3 mm. |
Säulenfüllung: | 10 % OV 17 auf Chromosorb WAW 80-100 mesh. |
Temperaturen: | Säule, Detektor, Injektor: 280 °C. |
Trägergas: | Stickstoff, sauerstofffrei (Anm.: richtig: sauerstoffrei); Druck: 2,3 bar, Durchsatz: 30 ml/min. |
- 8. BERECHNUNG
- 8.1. Proportionalitätskoeffizient von Hexachlorophen
Dieser Koeffizient wird entsprechend dem gewählten Standard im Verhältnis zur Standardmischung berechnet.
Dabei ist:
h: | Hexachlorophen, |
kh: | sein Proportionalitätskoeffizient, |
m'h: | seine Masse in der Standardmischung in g, |
A'h: | seine Peakfläche, |
s: | der gewählte Standard, |
m's: | seine Masse in der Standardmischung in g, |
A's: | seine Peakfläche; |
daraus folgt:
- 8.2. Gehalt von Hexachlorophen in der Probe
h: | Hexachlorophen, |
kh: | sein Proportionalitätskoeffizient, |
Ah: | seine Peakfläche, |
s: | der gewählte Standard, |
ms: | seine Masse in der Mischung in g, |
As: | seine Peakfläche, |
M: | Masse der Probe in g; |
daraus folgt:
prozentualer Massenanteil von Hexachlorophen in der Probe:
- 9. WIEDERHOLBARKEIT (3)
Bei einem Hexachlorophengehalt von 0,1 % (m/m) darf die Differenz zwischen zwei an der gleichen Probe durchgeführten Parallelbestimmungen 0,005% nicht überschreiten.
‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑‑
(1) Da Hexachlorophen in den verschiedensten Erzeugnissen vorhanden sein kann, muß zuerst die Wiederfindung von Hexachlorophen in der Probe mit diesem Verfahren ermittelt werden, bevor Ergebnisse festgehalten werden. Wird nur eine geringe Wiederfindung ermittelt, so können Änderungen, wie andere Lösungsmittel (Benzol anstelle von Ethylacetat) usw. mit Zustimmung der beteiligten Partner vorgenommen werden.
(2) Die Fortdauer der Gelbfärbung weist auf einen Überschuß an Diazomethan hin, der für eine vollständige Methylierung der Probe notwendig ist.
(3) Siehe ISO-Norm 5725.
Zuletzt aktualisiert am
09.05.2017
Gesetzesnummer
10010899
Dokumentnummer
NOR12138663
alte Dokumentnummer
N8199547970J
Zusatzdokumente: image001, image002, image003, image004
Lizenziert vom RIS (ris.bka.gv.at - CC BY 4.0 DEED)